曲安奈德注射用混悬液表现出显著的临床变异性;例如,使用标准溶出度检测方法测量达到体内最大浓度的时间(Tmax)可以从 1 到 216 小时不等。FDA 将这种可变性归因于悬浮液在体内絮凝的可能性。

FDA 还表示,一种更接近地模拟产品性能的方法可能与以下事实有关:可注射混悬剂是肌肉注射,因此注射部位周围的体液流动很小,不像静脉注射液进入循环,有大量液体并且快速流动。
FDA 认为,当前溶出度仪的高剪切特性可能会显著导致体外溶出度结果与体内药代动力学行为观察结果之间的差异。文章描述了 FDA 关于将体外溶出度与长效注射混悬液产品的体内性能更紧密联系起来的观察和研究。
用于提高患者顺应性的注射悬浮液
大多数 FDA 批准的可注射混悬液都具有持续的药物释放特性,从而提高药品的便利性(即,减少给药频率)和治疗效果(即,控制药物释放和减少副作用)。例如,单次注射曲安奈德混悬液可以将患者的治疗获益从数小时延长至数天或数周。此外,注射混悬液对于慢性疾病的有效长期管理也非常有帮助,例如用于精神分裂症维持治疗的 1 个月和 3 个月帕潘立酮棕榈酸酯注射液。但与速释注射剂相比,药物释放持续时间延长,再加上一剂注射剂悬浮液中所含的药物量相对较高,在某些情况下可能会带来更高风险。因此,充分了解注射悬浮液的配方设计和质量非常重要。
体外或体内方法的配方设计和挑战
纳米至微米尺寸范围内的结晶药物颗粒悬浮液通常用于缓释注射制剂,尤其是在药物成分水溶性较差的情况下。因此,药物的释放和随后的体内吸收主要由粒度和粒度分布以及颗粒溶出速率决定。因此,了解相关颗粒的大小和相关溶出行为对于评估产品的治疗性能至关重要。体外和体内方法都已用于了解注射悬浮液产品的溶出特性。一般来说,体外方法很容易在实验室中进行,可以提供高重现性和灵敏度,并且相对具有成本和时间效益;然而临床研究对于评估生理相关特征和治疗结局的有意义的可预测性至关重要。
为解决体外和临床数据之间的信息差距,CDER 研究人员将曲安奈德混悬注射液作为模型进行研究,以开发改进的方法来评估注射液性能。[1]曲安奈德混悬注射液表现出显著的临床变异性;例如,达到体内最大浓度的时间(Tmax)的测量值可以从 1 到 216 小时不等。[2-4]重要的是要注意,对于其它曲安奈德剂型(静脉内、鼻内、口服、局部)并未观察到此类高变异性;[5]相反,高临床变异性似乎与悬浮颗粒的絮凝状态有关。
悬浮液通常设计成絮凝或形成弱结合的附聚物,以增加产品稳定性。絮凝是一种复杂的现象,受粒子-粒子相互作用的支配,并且是可逆的,因此摇晃小瓶(例如,按照“使用前摇匀”的标签说明)很容易导致松散的聚集体(即,“二级”粒子)过渡到更小的“初级”粒子。对于曲安奈德悬浮注射液,絮凝可以迅速逆转,絮凝物(数十微米)通过应用剪切应力分解成初级颗粒(1 至 2 微米)。[1]CDER 研究人员进一步确定,通常在搅拌、泵送、超声处理甚至针刺注射时发生的剪切应力会影响絮凝状态,也可能影响药物溶出速率。
开发测量药物溶出度的新方法
CDER 研究人员开发了新方法来了解絮凝状态对药物溶出的影响。混悬液产品常用的体外溶出度检测方法一般是在高剪切环境(例如,快速搅拌)下的高稀释度(即,漏槽条件)下进行;然而,高稀释度和高剪切可能无法反映与肌肉注射相关的溶出条件。事实上,肌肉注射会导致发生溶出的非漏槽(即,浓缩)条件,因为注射部位的体液灌注非常有限。因此,CDER 研究人员开发了一种体外溶出方法,该方法可以最大限度地减少剪切,同时将悬浮颗粒保持在更接近临床相关情况的非漏槽条件(图1)。
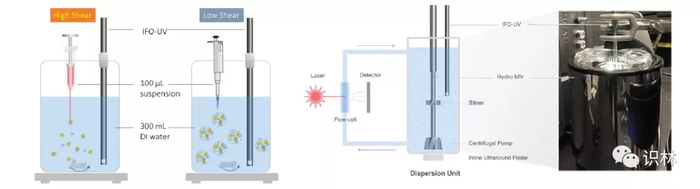
图1. 评估粒度对注射悬浮液中药物溶出度影响的新方法。左图:具有连续原位光纤(IFO)紫外(UV)监测的非漏槽溶出装置:剪切对悬浮液溶出的影响。右图:激光衍射流通池和带 IFO-UV 探头的分散装置之间的内部流路视图,用于同时测定溶出和粒度。[1]
CDER 科学家测试了以下假设,即,悬浮注射剂(而不是其它制剂)所观察到的溶出度的高可变性可能与絮凝状态有关。如图 2 所示,在引入混悬液期间注射器引起的剪切极大地影响了药物溶出度。此外,在一种新的检测装置中使用了非漏槽溶出方法,该装置将原位光纤(IFO)紫外-可见(UV-Vis)光谱与激光衍射(LD)相结合,以同时监测颗粒溶出和粒度分布,从而深入了解溶出机制(图1)。具体而言,IFO UV-Vis-LD 方法提供了絮凝和反絮凝颗粒遵循不同溶出途径的证据。
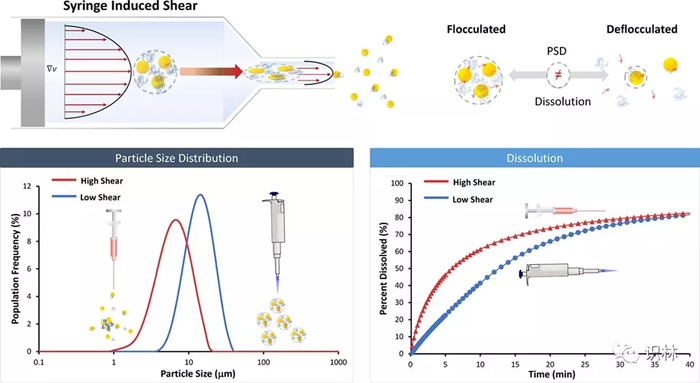
图2. 可视化针头注射过程中剪切对颗粒絮凝(上图)的影响以及随后对粒度分布(左下)和溶出(右下)的影响。[1]
溶出特征的结果和理解
CDER 最近的这些研究表明,适当设计的体外实验可以深入了解临床相关条件下的产品性能。研究人员发现 , 一方面絮凝/反絮凝行为与粒度分布存在很强的相关性,另一方面与药物溶出速率之间也存在很强的相关性,这种相关性对于理解混悬剂的物理稳定性以及临床结局可能的变异具有重要的影响。此外 , 曲安奈德注射液的给药方法或注射程序(例如,注射速率和针头大小)的变化会影响药物颗粒的絮凝状态 , 进而影响药物溶出速率(图2)。因此,适当控制曲安奈德注射液的给药程序(从而控制剪切应力)对于减轻临床结局的变异性至关重要。
研究如何帮助类似悬浮注射液产品的监管审评?
CDER 研究人员开发了新方法来弥合悬浮注射液体外和体内评估之间的差距。该研究阐明了由给药方法的变化引起的可注射溶液之间絮凝特性的差异如何解释药代动力学变异的来源。
[1] Smith WC, Bae J, Zhang Y, Qin B, Wang Y, Kozak D, Ashraf M, Xu X. Impact of particle flocculation on the dissolution and bioavailability of injectable suspensions. Int J Pharm. 2021 Jul 15;604:120767. doi: 10.1016/j.ijpharm.2021.120767. Epub 2021 Jun 1. PMID: 34087414.
[2] Kivitz A, Kwong L, Shlotzhauer T, Lufkin J, Cinar A, Kelley S. A randomized, phase IIa study to assess the systemic exposure of triamcinolone acetonide following injection of extended-release triamcinolone acetonide or traditional triamcinolone acetonide into both knees of patients with bilateral knee osteoarthritis. Ther Adv Musculoskelet Dis. 2019 Oct 16;11:1759720X19881309. doi: 10.1177/1759720X19881309. PMID: 31662801; PMCID: PMC6796206.
[3] Chang CW, Huang TY, Tseng YC, Chang-Chien GP, Lin SF, Hsu MC. Positive doping results caused by the single-dose local injection of triamcinolone acetonide. Forensic Sci Int. 2014 Nov;244:1-6. doi: 10.1016/j.forsciint.2014.07.024. Epub 2014 Jul 30. PMID: 25126738.
[4] Coll S, Monfort N, Alechaga É, Matabosch X, Pérez-Mañá C, Ventura R. Additional studies on triamcinolone acetonide use and misuse in sports: Elimination profile after intranasal and high-dose intramuscular administrations. Steroids. 2019 Nov;151:108464. doi: 10.1016/j.steroids.2019.108464. Epub 2019 Jul 22. PMID: 31344406.
[5] Derendorf H, Hochhaus G, Rohatagi S, Möllmann H, Barth J, Sourgens H, Erdmann M. Pharmacokinetics of triamcinolone acetonide after intravenous, oral, and inhaled administration. J Clin Pharmacol. 1995 Mar;35(3):302-5. doi: 10.1002/j.1552-4604.1995.tb04064.x. PMID: 7608322.
















评论
加载更多