应用PAT技术提高生物制药效率
随着上游构建筛选技术和细胞培养技术的不断提升,以细胞为宿主的药物开发,已从过往低表达转变为规模化细胞培养和高目的蛋白或病毒滴度表达,从而满足日益上涨的市场需求,生产规模和表达量的上升必然会对蛋白下游纯化工艺提出新的挑战[1]。针对生物制药领域下游纯化工艺稳定性和重复性相对较差的境况,美国食品药品监督管理局(FDA)于2001 年提出,面向21 世纪的cGMP 应纳入质量源于设计(QbD)的理念。近几年,随着医药生产实践经验的不断积累,市场对药品质量需进行科学监管的呼声日益高涨,以及在FDA 和人用药品注册技术要求国际协调会(ICH)的有关质量控制文件不断出台的推动下,QbD 的理念渐已成为制药界的共识[2]。
QbD 的本质是阐述产品质量是在设计时赋予的,而不是通过生产或检验注入到产品中的,是应用于生物医药研发、生产的一种理念,也是一种系统的、基于科学分析的方法。
我国2010 版GMP 也引入了“质量源于设计”的理念,强调了药品生产与药品注册、上市制度的有效衔接,药品一经获得批准,进入生产环节,就必须将与药品注册相关的安全性、有效性和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、贮存、发运的全过程,确保所生产的药品符合预定用途和注册要求。实施QbD 理念,将有助于全面提高我国药品生产水平和质量,并有助于企业获得国际商机。
QbD 理念的实施一般按以下流程进行,首先是对产品关键质量参数(CQAs) 和关键工艺参数(CPPs) 进行分析确认,建立产品知识库,再根据该知识库设计工艺过程使关键工艺参数符合预期,同时分析原材料和工艺过程参数等对产品质量的影响。在具体实施时,基于反馈控制的过程分析技术(PAT)的应用极大地改善和确保了工艺过程的稳定性和可重复性。
据FDA 定义,PAT 首先是一个系统,是依据生产过程中的周期性检测、关键质量参数的控制,原材料和中间产品的质量控制及生产全过程控制,确保终产品质量达到认可标准的程序。因其在促进和加强QbD 理念在医药生产和研发领域的实施而得到FDA 的大力推崇。
生物制药需要很多复杂的缓冲液,而缓冲液的准确和重复
对产品质量影响很大。以下将着重讨论以PAT 技术为基础的在
线液体稀释配制系统在生物药下游纯化配液过程中的应用。
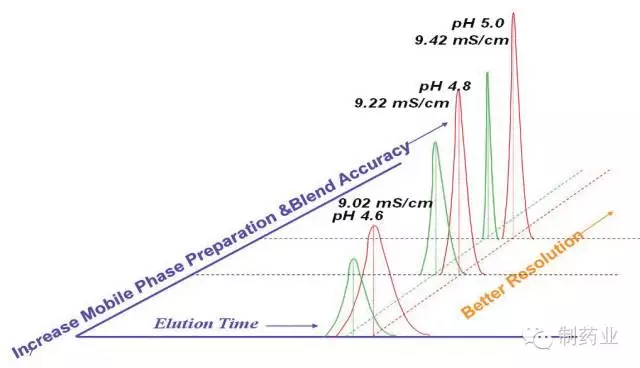
图1 缓冲液性质对层析分离效果的影响
众所周知,蛋白纯化工艺关键过程参数(缓冲液的电导率、pH 值等)对目的蛋白和杂质的层析分离过程有着显著的影响,如图1 中所示,当缓冲液pH为5.0 或电导率值为9.42 mS/cm时,目的蛋白与杂质可实现基线分离;当缓冲液降低 0.2 个pH 单位或离子强度降低0.2 mS/cm 时,部分杂质会重叠进入目的蛋白而使产品纯度下降,此时需做进一步后处理以获得所需的产品纯度;进一步降低pH 值或电导率值会导致杂质和目标蛋白完全不能分离。该实验提示到,对工艺缓冲液性质进行严格控制,是解决生产或研发重复性差,批间差异大的一个重要手段。
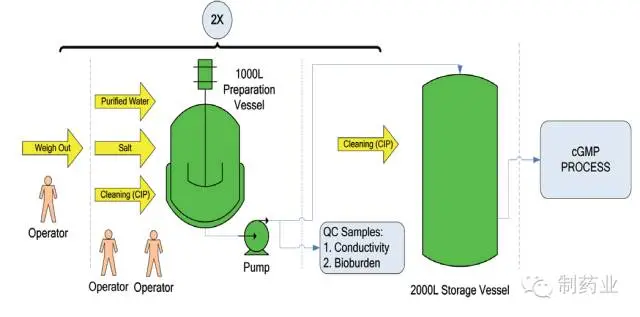
图2 传统配液系统
传统配液系统多依赖人工手动完成,如图2 中所示,配液罐规模为1 000 L,必须连续配制两次才可实现2 000 L 目标缓冲液的配制。该配液过程耗费人力物力多,且难以避免人为因素导致的差错,比如药品称量不准或稀释用注射用水加量偏差,并且目标缓冲液须通过质控的各项检测指标后方可用于生产,配液周期长。配液罐如用于其它液体的配制,还须进行彻底的清洁和验证。另一个不容忽视的问题是这些大的配液和储液罐将占用较多资金和厂方空间。

图3 液体在线稀释配制系统
传统配液方式存在的诸多问题和不便促使配液相关设备质量和性能的提升逐渐成为生物药领域关注的焦点,以PAT技术为基础的液体在线稀释配制系统的开发解决了以上潜在的监管和金融问题。图3 所示为荣捷生物工程(苏州)有限公司研发生产的符合GMP 要求的液体在线稀释配制系统。
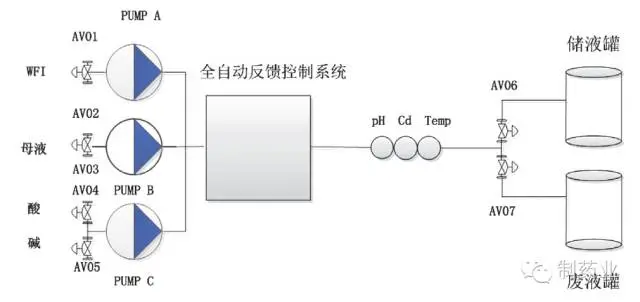
图4 PAT 在线液体稀释配制系统工艺流程图
如图4 所示,PAT 在线液体稀释配制系统共需3 台泵,分别与注射用水、母液和pH 调节用酸碱相连,通过pH、电导、温度等在线监测仪表实现对目标缓冲液的检测,并通过自动反馈控制系统调节各液体的流速及加量。
该配液系统已进行了相关缓冲液配制实验。其中泵A 与注射用水(WFI)相连,泵B 与1M 醋酸溶液连接,泵C 与1M Tris 溶液相连。目标是配制含216 mm 的Tris(1X)和284 mm 的醋酸缓冲液,已知目标缓冲液的电导率和pH 值分别为9.42 mS/cm 和5.04,将所需的电导率和pH 值作为系统的目标设定值,同时确定可接受的缓冲液标准,本实验规定目标缓冲液可接受波动范围为电导率值± 0.1 mS/cm 和± 0.1个pH 单位。
当3 种液体(注射用水、醋酸、Tris 碱)按比例泵入混合室时,浓缩母液被稀释至原倍目标缓冲液。此时,通过在线过程分析仪表(pH、电导和温度探头)对过程溶液进行监测,并把测量数据传输给过程反馈控制回路,控制系统将测量数据与目标值进行比对和计算来调节各泵输出情况。通过数据的持续监控与反馈调节,使过程缓冲液逐渐趋于目标设定值。当测量值不在可接受范围内时,液体通过废液阀和管路排出系统,直至各检测指标符合要求。只有合格的缓冲液才能进入储液罐或层析柱行生物药分离,从而确保层析分离工艺的稳定性和可重复性。
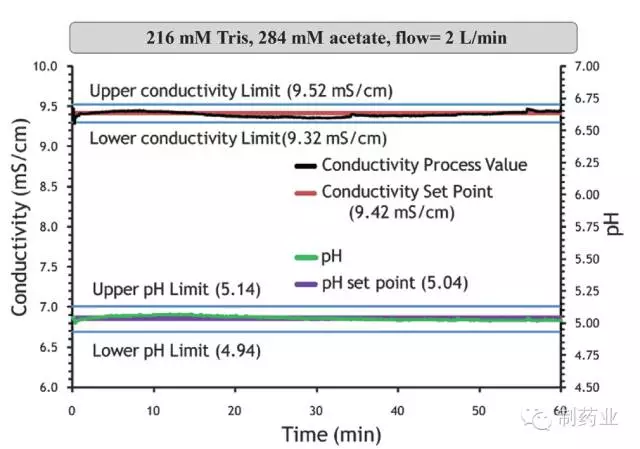
图5 1M 醋酸和1M Tris 在线配制目标缓冲液图谱
使用荣捷PAT 在线液体稀释配制系统的配液结果如图5 所示。电导率目标值和过程实时监测值分别用红线和黑线表示。pH 设定值和过程实时监测值分别用紫色和绿色线表示。可以看出,在系统60 min 的运行过程中,目标缓冲液的电导率和pH 值均在QbD 设计空间范围内。该实验表明PAT 液体在线稀释配液系统可实现配液过程的持续监测和偏差纠正,以保证缓冲液各检测指标的合格与稳定。精确的和可重复的液体配制,是层析分离效果与QbD 预先设计相符的前提条件之一。另外,使用该系统还可节省人员投入,规避人为因素导致的误差(如母液配制或药品称量)。不仅如此,还可减少配液罐和储液罐的使用,既节省厂房空间又大大减轻罐体清洁验证带来的烦恼。总之,PAT 在线配液系统的应用将在一定程度上提升QbD 理念在生物药领域的实施效果。目前,已有一些药企开始将QbD 理念和PAT 用于药物研发和生产,并有多篇论文发表用于阐述该理念的实施与效果。[3,4,5]
随着制药技术的发展和来自监管部门的压力,未来的药物开发和新药申报都将遵循质量源于设计的理念。如果我国制药企业早日依照QbD 原则进行新药和已上市产品的工艺研究,可以更加科学地保证药品质量、降低监管风险,使药品的开发、生产和监管更好的、可持续地满足人民群众对药品安全性、有效性和新药的需求。而鉴于QbD 理念推出不久,体系还需要通过理论研究和实践进行完善,这也为我国制药行业监管、开发生产体系跨越式发展、参与规则制定方面提供了很好的机会。
在国际上,从提出到鼓励普及,PAT 已经历了10 余年的时间。尽管国内还处于介绍和认识阶段,但是过程行业国际化特点明显,PAT 经过FDA 推介, 已经在具备代表性的过程行业——制药工业中展现重要作用,这是一个很好的行业机遇。不论国内外,PAT 的重要性还只是初露端倪,可以预计在下一个10 年,PAT 作为一个新的技术领域、一种新的理念、一种思维驱动方法,PAT 将在过程行业发挥其应有的作用。
【参考文献】
[1] McLeod LD. The Road to a Fully Disposable Protein Purification Process: Single-use Systems Eliminate time-Consuming, Nonrevenue generating activities. BioProcess Int. 7(6)2009: S4-S8.
[2] ICH: Pharmaceutical Development, 2006, May. Fed. Reg. 71(98)2006; www.ich.org/lob/media/MEDIA4986.pdf.
[3] Rathore AS, et al. Quality By Design: Industrial Case Studies on Defining and Implementing Design Space for Pharmaceutical Processes — Part 1. BioPharm Int. December 2008.
[4] Rathore AS, et al. Quality By Design: Industrial Case Studies on Defining and Implementing Design Space for Pharmaceutical Processes — Part 2. BioPharm Int. December 2008.
[5] Li, M.,Kamat, V., Yabe, H., Jariwala, S., Miyabayashi, T. PATbased In-line Buffer Dilution in Downstream Bioprocessing, Pharmaceutical Technology, October 1, 2010.
本文作者Michael Li,蔡月红。Michael Li 博士是荣捷生物工程( 苏州) 公司工艺副总;蔡月红是荣捷生物工程( 苏州) 公司疫苗工程师。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多