生物制品境外转移到境内的三大注册路径
过往,当谈到治疗用生物制品境外技术转移到境内,申请人一般都比较谨慎,原因在于监管方面对生物制品有一些特别要求。随着国家药监局加入ICH,从2018年到2020年,ICH各项指导原则在我国逐步落地实施,加之监管科学和“以患者为中心”理念的推进,中国药监正与国际接轨。

胰岛素能否成为境外转境内的模版?
当前,化药从境外转移到境内生产的案例较多,但生物制品的案例鲜有发生。今年6月,《已上市生物制品药学变更研究技术指导原则》《生物制品变更受理审查指南》等出台后,生物制品由境外技术转移到境内的注册路径和技术要求也相对明晰了。

如上图所示,在诺和诺德的胰岛素产品线中,有7个成功转移到境内生产,礼来的胰岛素产品赖脯胰岛素注射液也于今年获得批准。这些产品境外技术转移到境内生产的模式均是进口原液,在境内灌装制剂。
这些胰岛素产品成功转移到境内生产的经验和模式,能否用于其他生物制品?基于对生物制品管理的模式,这类产品技术转移到境内生产的模式还不能普遍用于其它生物制品,特别是单抗类的产品。原因在于:
生产场地技术转移的成功因素
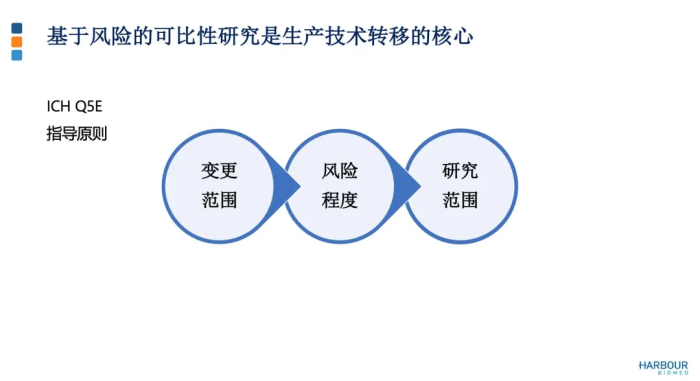
因此 ,在进行可比性研究时,要基于变更类型及变更引发的风险等级来制定可比性研究范围。基于产品可比性研究结果判断场地技术转移前后的产品质量是否等同或高度相似。
对于质量属性的差异,基于对产品知识了解和经验,预判这些差异会否对产品有效性和安全性产生影响。
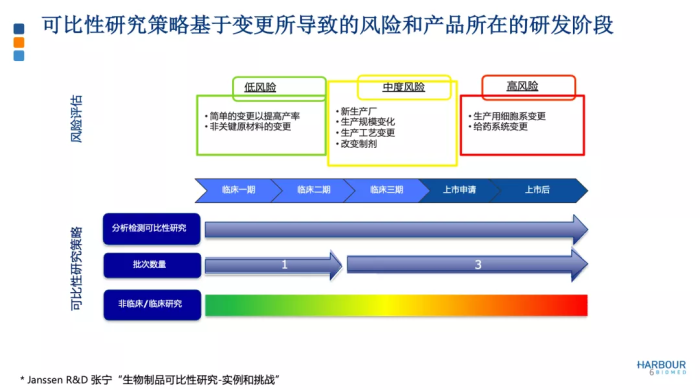
不同变更导致不同的风险等级。如果不涉及生产用细胞系变更或给药系统变更,这里列举的其它类变更属于中风险或低风险。对于生产技术转移过程中伴随的低风险或中风险的变更,可比性研究可基于 CMC的分析可比性,如果必要再加上非临床研究的可比性,证明生产场地变更前后产品的质量是否可比。
另外,生物制品的风险等级与研发阶段高度关联。在Ⅲ期临床试验阶段,生产场地和生产工艺基本锁定,如果发生场地变更或工艺变更,风险相对较高。
产品能否尽早顺利获批,对每家公司至关重要。在此阶段,要尽可能避免生产场地或生产工艺的重大变更。
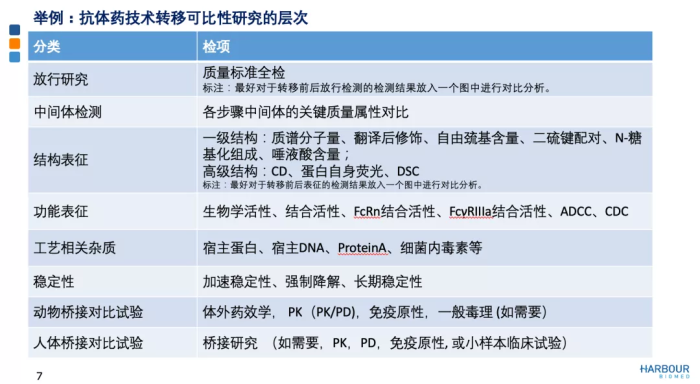
以抗体产品为例来说明技术转移中可比性研究的层次。首先,基于对产品了解和关键质量属性、质量控制策略的把控上,进行CMC层面头对头研究,变更包括前后放行检测、中间体检测、表征分析、杂质谱、稳定性研究加上工艺比对,以此判断生产场地转移前后产品质量是否可比。
基于风险管理的三种变更路径
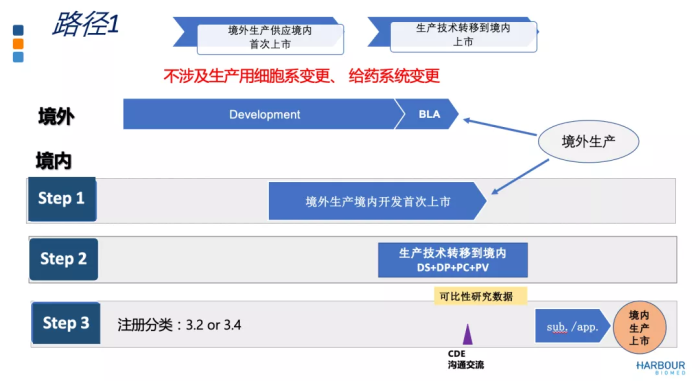
对于生物制品由境外转移到境内,有哪些注册路径可以考虑?
如上图所示,路径1较传统,用境外生产的产品供应境内首次上市。在现有法规下,如果做好计划和执行,中国参与境外临床研究,以境外生产的产品供应境内外市场,可以实现境内外同步递交上市申请。在临床试验过程中,进行技术转移到境内并完成可比性研究。基于申请人与CDE的沟通交流,按照药品上市注册申请的程序和要求提出申请,获得批准后就可用境内生产的产品供应中国市场,实现由境外生产供应转境内生产供应。为避免生产技术转移可能出现的临床研究要求,这一阶段不建议涉及生产用细胞系的变更或给药系统的变更。

目前还没有除胰岛素产品以外的其它生物制品生产场地转移案例,这里列举的案例是境外产品上市后的生产场地转移所做的可比性研究。这个重组糖蛋白产品上市后,涉及原液生产场地从欧洲变更到美国,同时有细胞培养工艺的改进、纯化工艺调整。企业基于 CMC分析的可比性,还有非临床可比性研究,证明了生产场地的转移是成功的。场地转移后,产品与转移前的质量可比,最后也获得了FDA的批准。
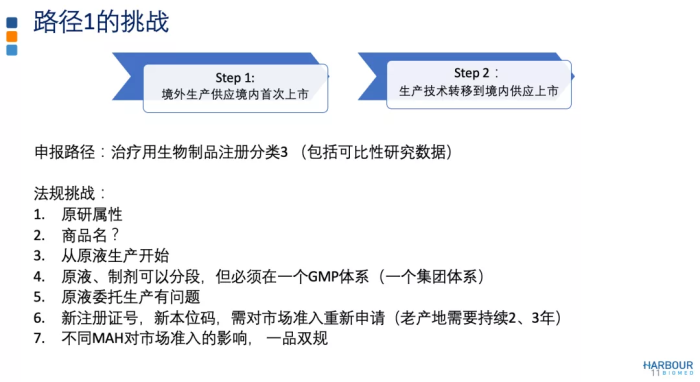
路径下的法规挑战包括原液制剂分段生产、商品名、市场准入等问题。
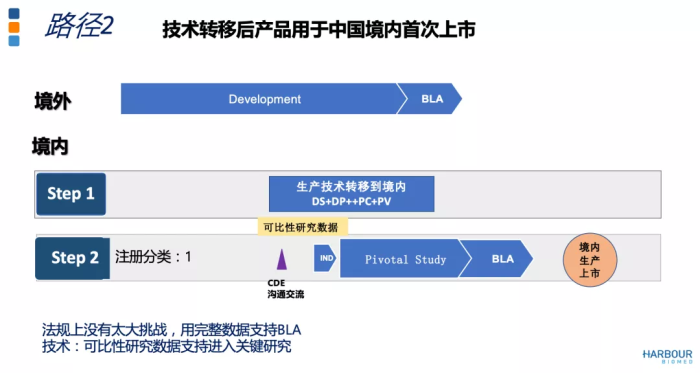
路径2是技术转移后的产品用于我国首次上市。这一路径要求生产技术转移要在产品研发的早期进行。基于可比性研究,与CDE沟通,是否能免除早期临床研究,如果必要可用PK研究桥接。这个路径下,在我国进行关键性临床研究,一定要用技术转移后的产品完成,用完整的研究数据支持生物制品上市,由此可使用境内生产的产品在我国的首次上市。

这里列举的是一个单抗产品在开展临床III期前的生产场地技术转移,包括原液和制剂,原液还涉及培养基变更及工艺调整和优化。这不是严格的由境外转到境内的变更。用于支持场地变更的数据包括:变更前后工艺的比对,变更前后原研和制剂三批次的分析记录、放行检测、原液和制剂的稳定性研究,中间体杂质谱的检测以及表征分析,最后基于可比性研究结果,CDE批准了产地变更。

展望未来
对境外生产技术转移到境内,首先从技术考量上,基于风险的可比性研究是核心,针对场地技术转移伴随的变更类型和风险评估制定可比性研究策略。对产品知识、工艺、关键质量属性详细深入的了解是可比性研究成功的关键;其次,要与监管部门尽早沟通,针对生产场地技术转移需完成的可比性研究策略达成一致。行业正处在新的法规体系下,新法规意味着新机会,有关生物制品由境外技术转移到境内,需要申请人和监管机构共同探索、积累经验。期盼有更多生物制品成功转移到境内,惠及中国患者。

本文来源于研发客
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多