过去这些年,同类首创(First-In-Class,FIC)和同类最佳(Best-In-Class,BIC)受到非常大的重视,因为一款产品是否是FIC、BIC会影响其市场潜力和竞争优势。一款药物是否具有FIC的实力或潜力,可以简单地理解为它是否是针对某一靶点或适应症或分子实体的首个获批的药物,而一款药物是否具有BIC的实力或潜力,最好基于头对头临床试验的结果进行判断。
近日,海外行业媒体提名了
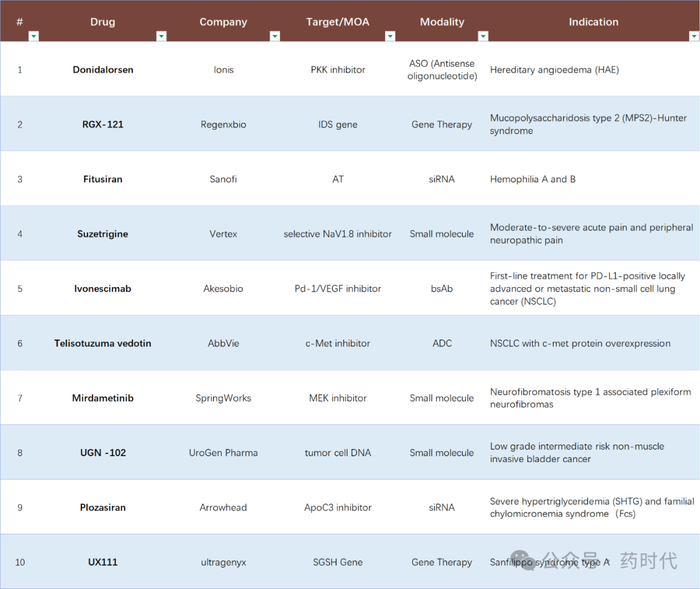
2025年有望获得FDA批准的10款FIC药物
,其中包括中国康方生物自主研发的全球首创PD-1/VEGF双特异性抗体新药依沃西。特别值得一提的是,
不久前,全球医疗领域领先的行业咨询及市场调研机构Evaluate发布了2025年制药行业展望(2025 Preview:What does the year ahead hold for pharma?)深度报告,以预测2025年全球医药市场发展格局。依沃西凭借其卓越的创新价值与市场潜力,入选“全球最具价值研发项目(Most Valuable R&D Projects)”榜单,
是该榜单中唯一一款来自中国创新药企自主研发的药物
。
2025年有望获得FDA批准的10款FIC药物
一款药物究竟是不是FIC或BIC,仁者见仁智者见智,很多时候难以达成共识。现在,我们请火热的似乎无所不能的DeepSeek帮助快速点评一下。


好的,我需要分析用户提到的这些药物是否具有First-in-class的潜力,并且可能在2025年获得FDA批准。首先,我需要确认每个药物的作用机制、当前研发阶段以及可能的竞争对手。
首先列出每个药物:
1. Donidalorsen:用于遗传性血管性水肿,反义寡核苷酸。同类药物可能包括Takhzyro(lanadelumab),但作用机制不同,可能First-in-class?
2. RGX-121:针对MPS II的基因疗法。MPS II现有疗法是酶替代疗法,如Idursulfase,但基因疗法可能属于新类别。
3. Fitusiran:血友病,靶向抗凝血酶RNA的小干扰RNA。现有的是因子替代疗法,fitusiran的作用机制不同,可能First-in-class。
4. Suzetrigine:非阿片类镇痛药,Nav1.8抑制剂。目前市场上是否有类似机制的药物?需要查证。
5. Lvonescimab:PD-1/VEGF双抗,癌症治疗。检查是否有其他双抗药物获批,可能属于First-in-class。
6. Telisotuzuma vedotin:ADC靶向c-Met,非小细胞肺癌。其他c-Met抑制剂存在,但作为ADC可能新。
7. Mirdametinib:MEK抑制剂,神经纤维瘤。MEK抑制剂已有,但适应症不同可能有潜力。
8. UGN-102:非手术膀胱癌疗法,丝裂霉素凝胶。现有膀胱癌疗法多为手术或BCG,这可能新。
9. Plozasiran:ANGPTL3 siRNA,高脂血症。同类如Evkeeza是抗体,siRNA机制不同。
10. UX111:针对白质营养不良的基因疗法。类似Zolgensma,但适应症不同,可能First-in-class。
需要逐个确认每个药物的机制是否首创,是否有同类药物已获批。例如,反义寡核苷酸药物已有,但适应症不同可能算First-in-class。基因疗法如RGX-121若为首次治疗MPS II的基因疗法,则是First-in-class。Fitusiran作为siRNA治疗血友病,可能属于新类别。Suzetrigine的Nav1.8抑制剂若未有其他获批,则是首创。双抗药物lvonescimab结合PD-1和VEGF,目前可能没有类似药物。ADC药物Telisotuzumab vedotin的靶点组合是否首次?需要查证。UGN-102作为化疗凝胶可能属于新疗法类型。Plozasiran作为ANGPTL3的siRNA,Evkeeza是抗体,机制不同。UX111作为特定基因疗法,如果适应症未有其他基因疗法,则是First-in-class。
另外,需考虑FDA审批的进度,是否有突破性疗法认定、快速通道等,这些可能影响2025年批准的可能性。例如,部分药物可能处于III期,接近申请阶段,而有些可能还在早期。需要确认各自的研发阶段和预计完成时间。
可能存在的误区是,某些药物的机制已有其他药物使用,但适应症不同是否仍算First-in-class?例如,MEK抑制剂mirdametinib可能已有其他MEK药物,但用于神经纤维瘤可能是首次,因此在该适应症中是First-in-class。同样,基因疗法RGX-121若针对MPS II首次,则是First-in-class,即使其他基因疗法用于其他疾病。
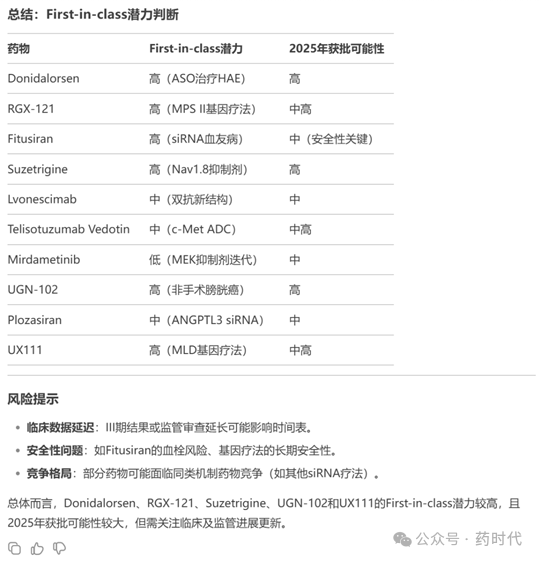
总结每个药物的可能性,然后给出结论,哪些可能被认定为First-in-class,并可能在2025年获批。同时需注意潜在风险,如临床试验延迟、安全性问题等可能影响批准时间。
以下是对所列药物是否具有First-in-class潜力及2025年FDA批准可能性的分析,基于当前公开信息及研发进展:
1. Donidalorsen
2. RGX-121
机制:AAV基因疗法,治疗黏多糖贮积症II型(MPS II,亨特综合征),通过递送IDS基因。
潜力:现有疗法为酶替代疗法(如Idursulfase),RGX-121若获批将是首个针对MPS II的基因疗法,明确First-in-class。
进展:I/II期数据积极,可能通过加速审批通道,2025年有望获批。
3. Fitusiran
机制:siRNA靶向抗凝血酶(AT),用于血友病(A/B型),通过调节凝血平衡。
潜力:与传统因子替代疗法或双特异性抗体(如Hemlibra)不同,作为RNAi疗法,属First-in-class。
进展:III期试验中,但安全性(血栓风险)需关注,可能2025年获批。
4. Suzetrigine(VX-548)
机制:选择性Nav1.8抑制剂,非阿片类镇痛药,用于急慢性疼痛。
潜力:Nav1.8靶点尚未有获批药物,若成功将成为全新机制镇痛药,First-in-class明确。
进展:III期进行中,适应症优先级高,2025年可能获批。(药时代备注:该产品的NDA申请已经于2025年1月30日获得FDA批准)
5. Ivonescimab(AK112)
机制:PD-1/VEGF双抗,用于**非小细胞肺癌(NSCLC)**等实体瘤。
潜力:首个PD-1与VEGF双靶点药物,相比单抗联合疗法(如Keytruda+贝伐珠单抗),结构创新,可能被认定为First-in-class。
进展:中国III期数据积极,全球多中心试验推进中,2025年可能提交BLA。
6. Telisotuzumab Vedotin
机制:ADC药物(c-Met靶向),用于c-Met高表达NSCLC。
潜力:c-Met ADC尚无获批药物,但已有小分子c-Met抑制剂(如卡马替尼),可能被归为First-in-class。
进展:II期数据支持加速审批,2025年有望获批。
7. Mirdametinib
机制:MEK抑制剂,用于神经纤维瘤病1型(NF1)相关丛状神经纤维瘤。
潜力:MEK抑制剂(如司美替尼)已用于NF1,但Mirdametinib若针对特定亚型或更优疗效,可能成为该适应症的Best-in-class,而非严格First-in-class。
进展:II期完成,III期或加速推进,2025年存在获批可能。
8. UGN-102
机制:丝裂霉素凝胶,用于**低级别非肌层浸润性膀胱癌(NMIBC)**的非手术疗法。
潜力:首个通过局部化疗诱导肿瘤消退的疗法,相比传统手术/BCG灌注,属First-in-class。
进展:III期数据积极,2024年提交NDA,2025年获批概率高。
9. Plozasiran(ARO-ANG3)
10. UX111(ABO-102)
机制:AAV基因疗法,治疗白质营养不良(MLD),补充ARSA基因。
潜力:MLD尚无有效疗法,若获批将是首个基因疗法,明确First-in-class。
进展:I/II期数据积极,可能通过优先审查,2025年或获批。
(备注:DeepSeek很专业,也很贴心,还专门制作了表单来进行总结)
您觉得DeepSeek在这一方面的表现如何?您赞同DeepSeek的点评吗?
以上内容仅供参考。欢迎感兴趣的朋友们继续阅读,更多了解这十款药物,发现其背后的潜在商机!
2025年被认为是创新药物获批的关键年份,多款FIC疗法已进入FDA审批冲刺阶段。这些药物覆盖罕见病、肿瘤、代谢疾病等多个领域,部分疗法甚至可能填补现有治疗空白。
1. Donidalorsen
点评:Donidalorsen是一种RNA靶向药物,用于预防遗传性血管性水肿(Hereditary Angioedema, HAE)的发作。HAE是一种罕见的遗传性疾病,患者会反复出现严重的肿胀发作。FDA已接受Donidalorsen的新药申请(NDA),并设定了2025年8月21日的PDUFA日期。
Donidalorsen被认为具有“First-in-class”(同类首创)潜力,主要基于以下几个方面:
创新的作用机制:Donidalorsen是一款RNA反义寡核苷酸配体偶联(LICA)药物,通过靶向前激肽释放酶(PKK)的mRNA,抑制其表达,从而中断导致遗传性血管性水肿(HAE)发作的通路。这种靶向RNA的技术在HAE治疗领域是首创的,与现有疗法相比,具有更高的特异性和精准性。
显著的临床效果:在3期临床试验中,Donidalorsen显著降低了患者的HAE发作频率,超过90%的患者在治疗后症状得到显著改善。此外,该药物还显著改善了患者的生活质量。
良好的安全性和耐受性:在临床试验中,Donidalorsen表现出良好的安全性和耐受性,没有发生与药物相关的严重不良事件。
先进的技术平台:Donidalorsen采用了Ionis的先进LIgand-C结合Antisense(LICA)技术,通过在反义寡核苷酸(ASO)上偶联GalNAc3分子,实现对肝脏的靶向递送。这种技术可以降低产生疗效所需的用药剂量,延长疗效持续时间,同时减少全身性副作用。
孤儿药资格认定:Donidalorsen已获得美国FDA授予的孤儿药资格,并且在欧盟的孤儿药资格正在审评中。孤儿药资格不仅有助于加速药物的开发和审批流程,还为药物的市场独占期提供了额外保护。
综上所述,Donidalorsen凭借其创新的作用机制、显著的临床效果、良好的安全性和耐受性,以及先进的技术平台,被认为具有“First-in-class”的潜力。
2. RGX-121
点评:RGX-121通过单次注射递送功能性基因,从根源上修复缺陷。2023年公布的Ⅰ/Ⅱ期数据显示,患者脑脊液中的硫酸乙酰肝素水平显著降低,长期安全性数据将是获批关键。
RGX-121被认为具有“First-in-class”(同类首创)潜力,主要基于以下几个关键因素:
创新的基因治疗技术:RGX-121是一种基因疗法,利用AAV9载体将编码人艾杜糖酸-2-硫酸酯酶(IDS)的转基因递送至中枢神经系统(CNS)。这种技术能够突破血脑屏障,为患者提供一个永久性的IDS分泌源,从而纠正或修复周围细胞的遗传缺陷或功能异常。
显著的临床效果:在关键性临床试验中,RGX-121显著降低了患者的脑脊液中D2S6水平(一种关键生物标志物),平均降低86%,接近正常水平。此外,接受治疗的患者中80%在最近一次随访时不需要接受标准的静脉输注酶替代疗法。
长期疗效与耐受性:长期随访数据显示,接受RGX-121治疗的患者表现出持续获益,且耐受性良好,没有发生与药物相关的严重不良事件。
突破现有治疗局限:目前针对MPS II(亨特综合征)的酶替代疗法(ERT)无法穿过血脑屏障,因此无法解决中枢神经系统受累的问题。RGX-121通过基因治疗的方式,能够有效解决这一未满足的医疗需求。
监管支持与市场潜力:FDA已同意使用脑脊液中的硫酸乙酰肝素(HS)水平作为替代终点,支持RGX-121的加速批准。RGX-121已获得美国FDA授予的孤儿药资格、罕见儿科疾病认定、快速通道资格和再生医学先进疗法认定。这些认定不仅有助于加速药物的开发和审批流程,还为药物的市场独占期提供了额外保护。
合作与市场拓展:REGENXBIO与Nippon Shinyaku达成合作协议,共同开发和商业化RGX-121,这将有助于加速该药物的市场推广,并进一步验证其在治疗MPS II中的潜力。
综上所述,RGX-121凭借其创新的基因治疗技术、显著的临床效果、良好的耐受性以及监管支持,被认为具有“First-in-class”的潜力,有望为MPS II患者提供一种变革性的治疗方法。
3. Fitusiran
公司:赛诺菲
点评:Fitusiran通过抑制抗凝血酶合成,重新平衡凝血功能。其优势在于每月一次皮下注射,大幅提升依从性。2024年Ⅲ期数据证实,年出血率降低80%以上,有望成为首个非因子替代疗法。
Fitusiran被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的作用机制:Fitusiran是一种小干扰RNA(siRNA)药物,通过靶向抗凝血酶(antithrombin)的mRNA,降低抗凝血酶的水平,从而促进凝血酶生成,重新平衡止血功能。这种机制与传统的凝血因子替代疗法不同,能够为血友病A和B患者提供一种全新的预防性治疗方案。
广泛的适用性:Fitusiran是首个对伴有或不伴有抑制物的A型和B型血友病患者均有效的预防性止血方法。这意味着无论患者是否产生抗凝血因子的抑制物,Fitusiran都能有效预防出血事件。
显著的临床效果:在3期临床试验中,Fitusiran显示出显著的疗效。与传统治疗相比,Fitusiran预防治疗组患者的年化出血率降低了90%。此外,Fitusiran的给药频率为每月一次,明显减轻了患者的治疗负担。
先进的技术平台:Fitusiran采用了Alnylam公司的ESC-GalNAc偶联技术,这种技术增强了siRNA的效力和持久性,使得皮下给药更加有效。
监管支持与市场潜力:Fitusiran的PDUFA日期已定为2025年3月28日,并且其上市申请已获得中国国家药监局药品审评中心(CDE)受理。此外,Fitusiran还被纳入CDE的“关爱计划”试点项目,旨在加速罕见病药物的研发。
安全性与耐受性:在临床试验中,Fitusiran的安全性得到了进一步验证,尽管早期曾因血栓事件暂停试验,但调整剂量后未再出现严重不良事件。
综上所述,Fitusiran凭借其创新的作用机制、广泛的适用性、显著的临床效果以及先进的技术平台,被认为具有“First-in-class”的潜力,有望为血友病患者提供一种变革性的治疗选择。
4. Suzetrigine
点评:在美国阿片危机背景下,Suzetrigine的“非成瘾性”标签备受关注。其选择性抑制NaV1.8通道,对慢性疼痛效果显著。Ⅲ期试验显示,疼痛评分较安慰剂降低50%,安全性优于传统NSAIDs。
Suzetrigine(商品名Journavx)被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的作用机制:Suzetrigine是一种口服非阿片类药物,高度选择性地抑制电压门控钠通道NaV1.8。NaV1.8主要表达在外周痛觉神经元(伤害感受器)中,负责传递疼痛信号。与传统阿片类药物不同,Suzetrigine不作用于大脑,因此避免了成瘾风险。
显著的临床效果:在两项3期临床试验中,Suzetrigine显示出快速且显著的镇痛效果,与安慰剂相比,疼痛缓解效果具有统计学意义。此外,Suzetrigine的疗效与常用阿片类药物相当,但没有成瘾潜力。
良好的安全性和耐受性:Suzetrigine在临床试验中表现出良好的耐受性,最常见的不良反应包括瘙痒、肌肉痉挛、肌酸磷酸激酶水平升高和皮疹。在超过2400名受试者的临床试验中,未发现滥用或成瘾的证据。
监管支持:Suzetrigine获得了美国FDA的优先审查、快速通道和突破性疗法认定。FDA的批准标志着20多年来首个基于新机制的急性疼痛治疗药物的诞生。
市场潜力:全球疼痛管理市场规模庞大,预计到2028年将达到900亿美元。Suzetrigine的批准为非阿片类疼痛治疗提供了一个新的选择,有望减少对阿片类药物的依赖。
综上所述,Suzetrigine凭借其创新的作用机制、显著的临床效果、良好的安全性和耐受性,以及监管支持,被认为具有“First-in-class”的潜力,有望为中度至重度急性疼痛患者提供一种非阿片类的替代治疗方案。
5. Ivonescimab
公司:康方生物/Summit Therapeutics
适应症:c-MET过表达非小细胞肺癌(NSCLC)
点评:Ivonescimab是全球首款进入Ⅲ期的PD-1/c-MET双抗,通过同时阻断免疫抑制和致癌信号通路,解决耐药难题。2024年ASCO公布的数据显示,客观缓解率(ORR)达40%,尤其在EGFR耐药患者中潜力显著。
Ivonescimab(依沃西单抗)被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的双特异性抗体机制:Ivonescimab是一种全球首创的四价双特异性抗体,同时靶向程序性细胞死亡蛋白1(PD-1)和血管内皮生长因子(VEGF)。这种双靶点机制能够同时阻断PD-1/PD-L1介导的免疫抑制和VEGF介导的肿瘤血管生成。与联合疗法相比,Ivonescimab作为单一药物同时阻断这两个靶点,可能更有效地阻断这两个通路,增强抗肿瘤活性。
显著的临床疗效:在3期临床试验HARMONi-2中,Ivonescimab单药治疗显著降低了PD-L1阳性晚期非小细胞肺癌(NSCLC)患者疾病进展或死亡的风险,与帕博利珠单抗(Pembrolizumab)单药治疗相比,无进展生存期(PFS)的改善具有统计学意义(HR=0.51,95% CI:0.38,0.69;p<0.0001),降低风险达49%。这一结果被认为具有改变NSCLC一线标准治疗的潜力。
良好的安全性:与传统VEGF靶点相关的治疗相比,Ivonescimab显著降低了与VEGF靶点相关的毒副作用,显示出更好的安全性。
广泛的临床应用前景:Ivonescimab不仅在NSCLC中显示出显著疗效,还在其他多种实体瘤(如乳腺癌、肝癌、胃癌等)的临床试验中展现出良好的治疗潜力。此外,Ivonescimab已获得中国国家药品监督管理局(NMPA)的补充新药申请(sNDA)优先审评资格。
全球合作与市场潜力:Ivonescimab由康方生物自主研发,并与Summit Therapeutics达成合作,授予其在美国、加拿大、欧洲和日本等地区的开发和商业化独家许可权。这种全球合作模式有助于加速Ivonescimab的全球开发和市场推广。
综上所述,Ivonescimab凭借其创新的双特异性抗体机制、显著的临床疗效、良好的安全性以及广泛的临床应用前景,被认为具有“First-in-class”的潜力,有望为多种癌症患者提供一种全新的治疗选择。
6. Telisotuzumab Vedotin
点评:该药由抗c-MET抗体与微管抑制剂MMAE偶联,精准杀伤高表达肿瘤细胞。2023年加速审批申请因样本量问题被拒,但2024年扩大试验后,中位生存期延长至14.2个月,获批概率回升。
Telisotuzumab vedotin(Teliso-V)被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的药物结构与靶点:Teliso-V是一种靶向c-Met蛋白的抗体药物偶联物(ADC),其核心结构包括单克隆抗体、细胞毒素(单甲基澳瑞他汀E,MMAE)以及可裂解连接子。c-Met是一种受体酪氨酸激酶,在多种实体瘤中过表达,包括非小细胞肺癌(NSCLC)。目前尚无专门针对c-Met过表达NSCLC的获批疗法。
显著的临床疗效:在2期LUMINOSITY试验中,Teliso-V在c-Met高表达的NSCLC患者中显示出显著的疗效。独立中心审评(ICR)分析显示,c-Met高表达患者的客观缓解率(ORR)为35%,中位缓解持续时间(DOR)为9个月,中位总生存期(OS)为14.6个月。这些数据表明Teliso-V能够为c-Met过表达的NSCLC患者提供显著的临床益处。
良好的安全性:Teliso-V的安全性特征与既往研究一致,未发现新的安全性问题。其不良事件通常可控且耐受良好。
突破性疗法认定与市场潜力:Teliso-V已获得美国FDA授予的突破性疗法认定(BTD),用于治疗c-Met过表达的晚期/转移性EGFR野生型非鳞状NSCLC患者。此外,艾伯维已向FDA提交了生物制品许可申请(BLA),寻求加速批准Teliso-V用于治疗既往接受过治疗的c-Met过表达NSCLC患者。
未满足的临床需求:c-Met过表达的NSCLC患者目前缺乏有效的靶向治疗方案。如果Teliso-V获得批准,将成为首个专门针对这一患者群体的治疗药物,填补市场空白。
综上所述,Teliso-V凭借其创新的药物结构、显著的临床疗效、良好的安全性以及突破性疗法认定,被认为具有“First-in-class”的潜力,有望为c-Met过表达的NSCLC患者提供一种全新的治疗选择。
7. Mitdametinib
公司:SpringWorks Therapeutics
点评:Mitdametinib通过阻断MAPK通路抑制肿瘤生长。Ⅱ期试验中,60%患者肿瘤体积缩小≥20%。2024年获FDA突破性疗法认定,预计2025年初提交NDA,可能成为该适应症首个口服疗法。
Mirdametinib被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的药物机制:Mirdametinib是一种口服变构小分子MEK抑制剂,靶向MEK1和MEK2。它通过抑制MAPK信号通路中的关键蛋白MEK1和MEK2,显著减少肿瘤细胞的增殖。这种变构抑制机制使其区别于传统的ATP竞争性抑制剂,具有更高的选择性和特异性。
显著的临床效果:在关键2b期ReNeu试验中,Mirdametinib在治疗神经纤维瘤病1型相关丛状神经纤维瘤(NF1-PN)患者中表现出显著的肿瘤缩小效果。成人患者的客观缓解率(ORR)达到41%,儿童患者则高达52%,且疗效持久。此外,患者的疼痛和健康相关生活质量也得到了显著改善。
良好的安全性和耐受性:在临床试验中,Mirdametinib显示出良好的耐受性,大多数不良事件为1级或2级。这表明该药物在治疗过程中具有较低的副作用风险,适合长期使用。
满足未被满足的临床需求:NF1-PN是一种罕见的遗传性疾病,目前尚无有效的治疗方法。Mirdametinib有望成为首个获批用于治疗NF1-PN的药物,填补这一领域的空白。
监管支持:Mirdametinib已获得美国FDA授予的优先审评资格,PDUFA目标日期为2025年2月28日。此外,该药物还获得了孤儿药资格认定,这有助于加速其开发和审批流程。
广泛的适用性:除了NF1-PN,Mirdametinib还在其他肿瘤类型中显示出潜在的疗效,例如在低级别胶质瘤(LGG)患者中,Mirdametinib也表现出良好的临床活性。
综上所述,Mirdametinib凭借其创新的药物机制、显著的临床效果、良好的安全性和耐受性,以及满足未被满足的临床需求,被认为具有“First-in-class”的潜力,有望为NF1-PN患者提供一种全新的治疗选择。
8. UGN-102
公司:UroGen Pharma
点评:UGN-102通过局部灌注缓释化疗药物,减少手术需求。Ⅲ期数据显示,完全缓解率(CR)达65%,且耐受性良好。若获批,将颠覆传统手术+灌注的治疗模式。
UGN-102被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的药物递送技术:UGN-102利用了UroGen专有的缓释水凝胶技术(RTGel®),这种技术能够使膀胱组织更长时间地暴露于丝裂霉素,从而通过非手术方式治疗肿瘤。这种创新的递送方式显著延长了药物与膀胱癌组织的接触时间,提升了治疗效果。
显著的临床疗效:在3期临床试验ENVISION中,接受UGN-102治疗的患者在首次治疗后3个月的完全缓解率(CR)达到79.6%。此外,对于首次使用UGN-102治疗后3个月内达到完全缓解的患者,12个月的持续缓解率高达82.3%。这些数据表明UGN-102不仅能够迅速抑制肿瘤生长,其持久的治疗效果也为患者带来了长期获益的希望。
良好的安全性和耐受性:在ENVISION试验中,UGN-102的安全性概况与其他研究中观察到的结果相似,且通常耐受性良好。最常见的治疗伴发不良事件(TEAEs)包括排尿困难、血尿、尿路感染等,但这些事件通常为轻至中度。
满足未被满足的临床需求:目前,低分级中危非肌层浸润性膀胱癌(LG-IR-NMIBC)的标准治疗方法为经尿道膀胱肿瘤切除术(TURBT),但这种手术存在复发风险。UGN-102有望成为首个获得FDA批准的非手术治疗药物,为患者提供一种更微创的治疗选择。
监管支持:美国FDA已经接受了UGN-102的新药申请(NDA),并设定了2025年6月13日的PDUFA目标日期。这表明FDA对该药物的潜力给予了高度关注,并有望加速其审批流程。
综上所述,UGN-102凭借其创新的药物递送技术、显著的临床疗效、良好的安全性和耐受性,以及满足未被满足的临床需求,被认为具有“First-in-class”的潜力,有望为LG-IR-NMIBC患者提供一种全新的非手术治疗选择。
9. Plozasiran
公司:Arrowhead Pharmaceuticals
适应症:严重高甘油三酯血症(SHTG)及家族性乳糜微粒血症综合征(FCS)
点评:Plozasiran通过沉默ANGPTL3基因,降低甘油三酯水平。Ⅱ期试验中,患者甘油三酯水平下降80%,且疗效持续半年。其长效性可能成为血脂管理领域的新标杆。
Plozasiran被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的RNA干扰机制:Plozasiran是一种RNA干扰(RNAi)治疗药物,通过靶向并沉默载脂蛋白C-III(APOC3)的mRNA,减少其在肝脏中的产生。APOC3是甘油三酯代谢的关键调节因子,其减少能够显著降低血液中的甘油三酯水平。
显著的临床疗效:在3期PALISADE研究中,Plozasiran显著降低了家族性乳糜微粒血症综合征(FCS)患者的甘油三酯水平,中位降幅达到80%。此外,该药物还显著降低了急性胰腺炎的发生风险(风险降低83%),并显示出良好的耐受性。
满足未被满足的临床需求:FCS是一种罕见且严重的遗传性疾病,目前尚无FDA批准的治疗方案。Plozasiran有望成为首个专门针对FCS的药物疗法,填补这一领域的空白。
监管支持:lozasiran已获得美国FDA授予的突破性疗法认定、孤儿药资格和快速通道资格,这些认定有助于加速其开发和审批流程。此外,FDA已接受Plozasiran的新药申请(NDA),并设定了2025年11月18日的PDUFA行动日期。
广泛的临床研究计划:Plozasiran不仅在FCS患者中表现出色,还在严重高甘油三酯血症(SHTG)和混合性高脂血症患者中进行了临床研究,显示出降低多种致动脉粥样硬化脂蛋白的潜力。
综上所述,Plozasiran凭借其创新的RNA干扰机制、显著的临床疗效、满足未被满足的临床需求以及监管支持,被认为具有“First-in-class”的潜力,有望为FCS及其他相关疾病患者提供一种全新的治疗选择。
10. UX111
公司:Ultragenyx Pharmaceutical
适应症:Sanfilippo综合征A型(黏多糖贮积症ⅢA型)
点评:UX111通过递送SGSH基因,改善神经退行性病变。2024年公布的长期随访数据显示,患儿认知衰退速度减缓50%,但颅内注射的潜在风险仍需关注。
UX111被认为具有“First-in-class”(同类首创)潜力,主要基于以下几点优势和特点:
创新的基因治疗技术:UX111是一种新型体内基因疗法,使用AAV9载体将功能性SGSH基因递送至中枢神经系统和外周器官。这种技术能够突破血脑屏障,直接解决SGSH酶缺乏这一根本问题,从而减少硫酸乙酰肝素(HS)在大脑和身体其他部位的异常积累。
显著的临床疗效:在关键性Transpher A研究中,UX111显著降低了患者脑脊液中的HS水平,平均降低58.5%,且这种降低与患者长期认知功能的稳定或改善相关。与自然病程相比,UX111治疗组的认知功能显著改善。
满足未被满足的临床需求:MPS IIIA(Sanfilippo综合征A型)是一种罕见的致命性溶酶体贮积症,目前尚无获批的治疗方法。UX111有望成为首个获批用于治疗MPS IIIA的基因疗法。
监管支持:UX111已获得美国FDA授予的再生医学先进疗法(RMAT)认定、快速通道资格、罕见儿科疾病认定和孤儿药资格。此外,FDA已同意将脑脊液中的HS水平作为替代终点,支持UX111的加速批准。
广泛的临床研究计划:UX111目前处于1/2/3期临床开发阶段,其临床数据已显示出良好的安全性和耐受性,最常见的治疗相关不良事件为轻度或中度肝酶升高。
综上所述,UX111凭借其创新的基因治疗技术、显著的临床疗效、满足未被满足的临床需求以及监管支持,被认为具有“First-in-class”的潜力,有望为MPS IIIA患者提供一种全新的治疗选择。
总结与展望
2025年有望成为罕见病和肿瘤治疗的里程碑年份。基因疗法(如RGX-121、UX111)和RNA靶向药物(如Fitusiran、Plozasiran)的集中获批,将标志着精准医学进入新阶段。同时,非阿片镇痛药和新型ADC的突破,将重塑疼痛管理与肿瘤治疗格局。然而,高昂定价、长期安全性及医保覆盖仍是商业化挑战。未来,这些药物的真实世界表现,将决定其能否从“科学奇迹”转化为“患者福音”。

















评论
加载更多