慢病毒载体或存在缺陷,7人患上血癌
虽然此前Skysona已经被FDA贴上了可能致癌的黑框标签,但如此高的致癌概率(约10%,7/67)属实让人意外。新英格兰医学上的研究将问题指向了载体。
几乎是唯一选择
Skysona所治疗的疾病是一种罕见的神经退行性疾病——大脑性肾上腺脑白质营养不良(CALD),这是一种X连锁隐性遗传病(男性患者远多于女性患者),致病基因为ABCD1,由于ABCD1基因突变,极长链脂肪酸在血液、肾上腺以及脑白质部位产生异常的聚集,引发脑白质的病变和肾上腺皮质的萎缩,患儿常常在出现神经系统症状以后的1-3年内去世,很少有患儿活过20岁。传统的骨髓移植治疗方案中,想要找到合适HLA配型的骨髓移植患者也是一件难事,况且即便找到了配型了,GVHD的发生也可能要了患儿的命。
生与死的抉择下,Skysona几乎是患者家属的最优选择,FDA的专家会也认为即便有致癌风险,仍然是利大于弊。
Skysona作为一款采用Lenti-D慢病毒载体的基因治疗,能够传递ABCD1基因导入患者的造血干细胞,灌输回患者体内,从而促进能够表达功能性ALDP蛋白的成熟单核细胞的产生。
而这次研究诟病的主要问题就是Lenti-D慢病毒载体。
肇事的慢病毒载体?
研究人员对这次6例数据可获得患者进行了体细胞突变分析,出现的血液癌症与癌症相关基因中的克隆载体插入有关,并与体细胞原癌基因突变位点的积累有关。这些突变包括KRAS,WT1,CDKN2A,RUNX1等。
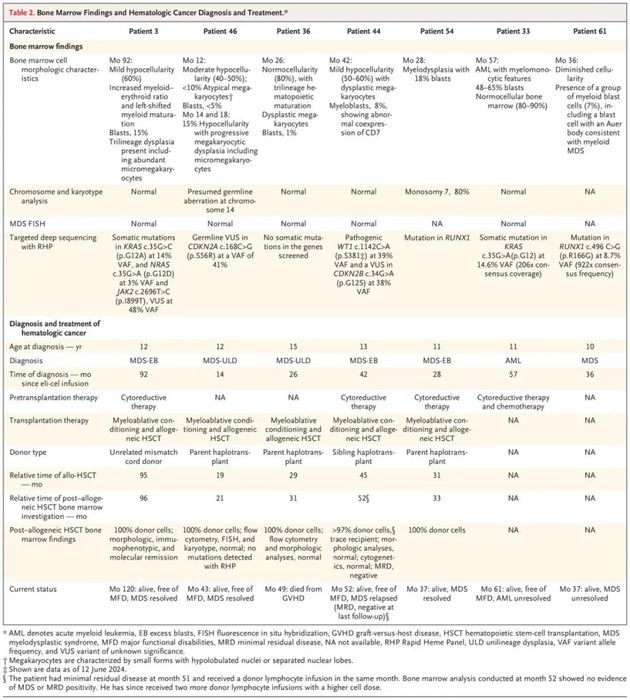
对于这一问题的原因,研究人员从Lenti-D的结构进行了简单推测:
这里他们将CAR-T常常用到的γ-逆转录病毒载体(例如Yescarta)和Lenti-D慢病毒载体进行了对比。
Lenti-D载体是一类具有自失活(self-inactivating, SIN)特性的慢病毒载体,从HIV-1改造而来,与γ-逆转录病毒载体不同,自失活慢病毒载体缺少强启动子-增强子长末端重复(LTR)序列,并优先整合到内含子中,远离活跃转录基因的转录起始位点。按理来说,自失活慢病毒载体应该更安全。
但是Lenti-D载体有个特征是,还具有一个MNDU3启动子/增强子元件以驱动ABCD1在多种细胞类型(包括脑巨噬细胞、小胶质细胞和造血干细胞)中的表达。
然而,这种元件来自于修饰的骨髓增生性肉瘤病毒(MPSV),是长末端重复(LTR)增强子-启动子。这意味着整合到宿主基因组中的前病毒包含一个来自长末端重复的完整启动子-增强子。
这种完整的增强子确实具有驱动附近内源基因的表达的潜力。原癌基因的突变很有可能是基因过度表达引起的遗传不稳定导致的。
研究人员认为以后设计慢病毒载体时,可能应该考虑一下启动子的问题。
生物制药小编
邵丽竹
何发
热点文章
-
OEB4级药品生产的法规要求
2025-05-16
-
抗体-药物偶联物的偶联技术总结
2025-05-11
-
"AI制药第一股"的晶泰控股,收购这一“中国最大”
2025-05-23
-
2024年生物制药行业收入Top20
2025-05-22
-
水凝胶在药物递送中的应用
2025-05-08
-
药品生产质量管理中变更控制的研究与分析
2025-05-30
-
国内三抗药物的开发现状
2025-05-13
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略














评论 0
正在获取数据......