基于药品上市后变更谈药物全生命周期的「CMC变更管理」
由此可见:
1)尽管理想状态下,我们期望变更不发生或者是少发生,但变是绝对的,不变是相对的,因此,对于每个药企来说都不可能避开变更,更少不了变更管理;
2)在药物全生命周期内,即从研发到退市的所有的阶段,变更均有可能发生。在药物生命周期各个阶段发生的变更有不同的特点以及应对方式。对于药物的研发阶段以及技术转移阶段,由于初期需要不断摸索处方工艺、质量标准、测试方法亦或工艺条件等,因此,对于前期的变更研究,可以说是频繁的。
但后期会有进一步的工艺验证研究及从产品未上市的角度思考,其变更的等级较低,变更相对简单。换句话说,药品上市后的变更管理是药品全生命周期管理的重点。


近几年来,国内监管机构对于MAH制度下的注册持有人提出了明确的要求,指出持有人是药品上市后变更管理的责任主体,为更好地做好已上市产品的变更管理,要加强学习,主动提升变更管理的能力和水平以及自身的研发能力和生产能力,更好地保障产品质量,持续提高创新水平,不断提高产品竞争力。
变更的管理
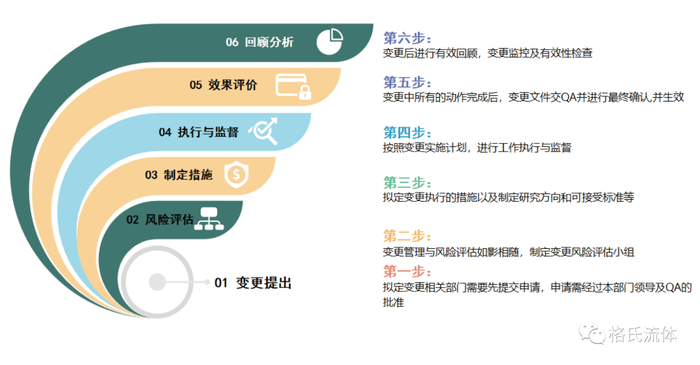
变更分类及国内外法规对比

案例及问答
问
针对化药制剂中等变更,按照已上市药学变更指导原则要求进行商业批规模的验证,其研究样品符合GMP放行标准,在完成备案后是否可以上市销售?
答
《药品上市后变更管理办法(试行)》政策解读中明确“二十五、备案的法律意义是什么?根据我国法律规定和国务院规定,备案不属于行政许可,不存在许可类备案,《办法》规定的备案均为告知性备案,由持有人对备案事项负主体责任。”因此,质量标准、生产工艺与注册证书一致的商业规模批次药品,其生产过程符合药品生产质量管理规范的,在完成备案后,符合产品放行要求的,可以上市销售;药品上市许可持有人应当对上述批次药品加强生产销售管理和风险管理。
——摘自《陕西省药监局对于变更的相关问题解答》
《已上市化学药品变更技术指导原则(试行)》于2021年02月正式试运行,笔者用对比表格(《征求意见稿》以及《试行版》)分析其中对于无菌制剂生产工艺中变更除菌过滤器相关事项的内容:

参考法规文献
撰稿人 | 乐纯生物LePure
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多