偏差流程要点分析和偏差处理成熟度的考量
Part
1
1.1
偏差概述
1.2
偏差的发现与报告
1.3
偏差分类

表1 与委托方协商共同管理偏差的方式
1.4
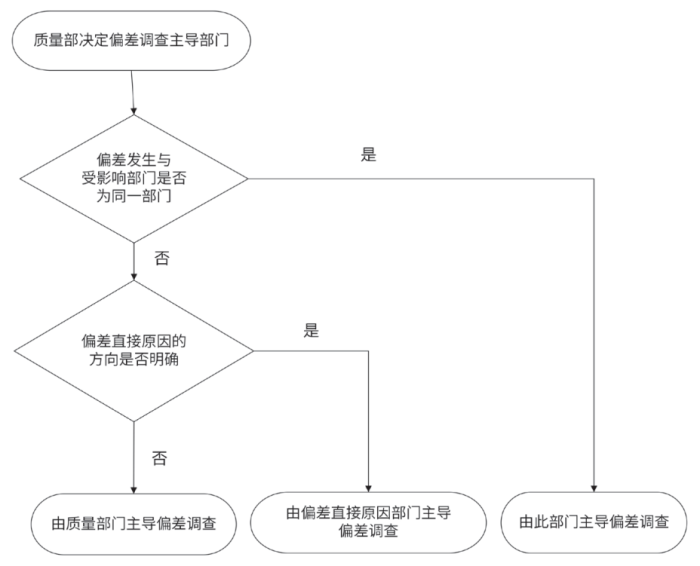
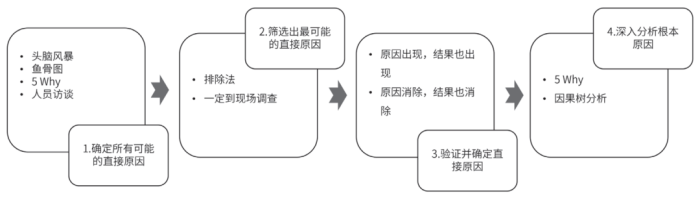
偏差的根本原因调查
1.5
重复偏差管理的重点
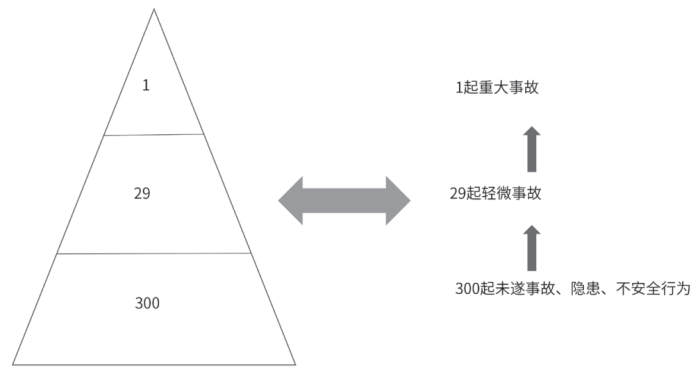
图3 海因里希安全法则
1.6
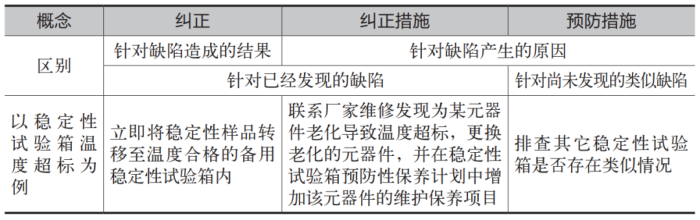
偏差的纠正措施与预防措施
Part
2
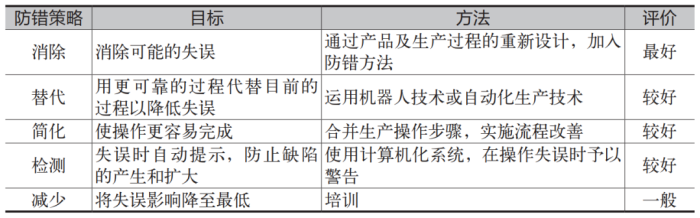
Part
3
参考文献
[1] 中华人民共和国卫生部 . 药品生产质量管理规范(2010 年修订)[EB/OL].(2011-01-17),https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/bgt/art/2023/art_d5e1dbaa8f284277a5f6c3e2fc840d00.html.
[2]ICH.Q7 Good Manufacturing PracticeGuide for Active PharmaceuticalIngredients [EB/OL].(2015-06-10).https://database.ich.org/sites/default/files/Q7%20Guideline.pdf.
[3]PDA.Root Cause Investigations forCAPA: Clear and Simple[J](2020-06). https://www.pda.org/bookstore/product-detail/5724-capa.
[4]ISPE, PDA. Guide to ImprovingQuality Culture in PharmaceuticalManufacturing Facilities[J].2019.https://ispe.org/initiatives/regulatory/quality-culture.
撰稿人 | 郑文科、张磊
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多