美国FDA《注射剂可见异物检查行业指南( 草案) 》介绍与解读
注射剂中的可见异物系指在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常>50μm[1]。注射剂中存在的可见异物进入体内可引起血管栓塞、静脉炎、肉芽肿和变态反应等,甚至全身感染,直接危害患者用药安全[2-4]。国内外注射剂中可见异物检查不合格以及由此引起的药品召回事件频发[5-8],美国FDA发布的2017年5月—2022年5月近5年共344起药品召回事件中[9],涉及可见异物不合格的高达30起,占比9.0%,仅次于微生物污染(50起)。
可见异物是注射剂一项重要的质量控制指标,国内外药品审评及监管机构都高度关注注射剂中可见异物的检查和控制。国内外药典均规定注射剂应对可见异物进行检查,并制定了可见异物检查方法通则,包括检查方法和结果判定标准。《中华人民共和国药典》(ChP)[10]规定注射剂不得检出明显可见异物,对于点状物、2mm以下的短纤维和块状物等微细可见异物也根据不同类型药物和不同给药途径制定了相应的可接受标准。美国药典(USP)[11-12]规定注射剂应基本不含可见异物(essentially free from visible particulates),欧洲药典(EP)[13] 和日本药典(JP)[14] 对注射剂中可见异物的要求与USP相似。同时各国药典和相关技术要求均明确注射剂生产过程中应对可见异物进行100% 检查并同时剔除不合格产品。美国FDA于2021年12月发布了《注射剂可见异物检查行业指南(草案)》[15][Inspection of Injectable Products for Visible Particulates Guidance for Industry(Draft Guidance),以下简称FDA指南草案],系统阐述了基于风险评估与生命周期管理的整体可见异物检查和控制策略,同时提出应在严格确保注射剂生产符合《药品生产质量管理规范》(GMP)要求的基础上,建立整体的控制策略。
本文主要参考FDA指南草案,并结合USP[16]、美国注射剂协会(PDA)TR No.79[17]、ChP[1]等国内外相关技术要求及实际审评工作经验,从可见异物概念、风险评估、生产过程控制和样品检查、生命周期管理等方面对注射剂中可见异物的控制策略进行梳理介绍,以期为我国注射剂可见异物的检查、控制和评价提供参考。
Part
1
可见异物是指注射剂中除气泡以外非有意添加的、可随液体流动、不溶的颗粒[15,18],如金属屑、玻璃屑、纤维、橡胶、沉淀物等。FDA指南草案未明确可见异物大小,ChP明确指出可见异物的粒径或长度通常>50μm[1]。
FDA指南草案根据可见异物的来源与性质,将可见异物分为以下3类。
1.1
固有异物
与特定产品或处方相关,如混悬液、乳剂或其他微粒药物递送系统等[16],属于制剂目标产品质量概况的一部分。通常情况下研究者对固有异物掌握信息相对较全面,因此其产生的风险也相对较低。
1.2
内源性异物
是指从生产设备、处方或容器密封系统等引入的可见异物,一般与制剂生产工艺相关。此类异物通常已随制剂一并经过灭菌或无菌处理,且研究者对其来源及可能的相互作用等信息掌握相对较全面[16],但与固有异物相比仍存在一定风险。
1.3
外源性异物
是指从生产环境中引入的异物,一般属于生产工艺之外的异物,比如头发、与生产无关的纤维、淀粉、矿物及类似的无机或有机材料等[16]。外源性异物通常是一次性出现,随机性很大,但由于一般无法准确获得其来源、进入制剂的途径及可能的相互作用等信息,因此可能存在微生物污染的风险[16]。
国内的可见异物分类与FDA指南草案存在较大差异。ChP大体上按不溶性物质大小并结合材质将可见异物分为明显可见异物和细微可见异物,材质上细分为金属类、玻璃类、纤维类、蛋白絮状物和其他类型,未将来源和风险等级等因素考虑在内,同时FDA指南草案中所说的固有异物也不属于ChP可见异物的范畴。相比之下,FDA 指南草案从来源、性质与风险等级等方面对可见异物进行分类,针对不同类别的可见异物分别制定相应的控制策略,分类更加合理科学,更有利于可见异物控制策略的制定。
Part
2
注射剂中的可见异物严重影响了药品的质量,患者使用后可导致血管栓塞、静脉炎、肉芽肿和变态反应,甚至全身感染等严重不良反应事件,直接危害患者用药安全,需要严格预防和控制注射剂中的可见异物问题。为确保药品质量并降低临床风险,应在产品开发过程对可见异物进行风险评估。采用适当的分析技术识别出典型可见异物并对其尺寸、数量及组成成分等进行表征和鉴定,进一步追溯其潜在来源并评估风险等级,从而有针对性地制定可见异物控制策略。通常固有异物、内源性异物与外源性异物可能引发的风险呈逐渐增加趋势,风险降低措施也应逐渐强化和全面。常见的可见异物分析识别技术[5,19]通常包括显微镜观察、拉曼光谱、激光诱导击穿光谱、红外光谱等。
2.1
固有异物
如果固有异物属于产品特性且满足制剂放行标准,则该异物可接受,但应在稳定性期间考察固有异物的尺寸或数量变化趋势。对于含固有异物的注射剂,可见异物检查存在较大的挑战,建议开发相关的补充检查方法,详见“3.1.4”项特殊注射剂的考量。
2.2
内源性异物
针对不同来源的内源性异物,在制定控制策略时应有相应的考量。
一方面,对于可能由生产设备(如配液罐、生产管路、硅胶管、过滤器、垫圈等)、原辅料或直接接触药包材(如玻璃或塑料瓶、胶塞、硅油等)等引入的内源性异物,首先应考虑从源头控制,结合产品特性谨慎选择可满足制剂需求的原辅包,制定比成品可接受标准更加严格的入厂标准,关注清洗工艺对设备、直接接触药包材等引入异物或颗粒的清除能力[16];其次,生产设施设备均应符合GMP要求,生产过程须严格遵守GMP对人员、厂房与设施设备、物料与产品、生产管理、质量控制与质量保证的要求;最后,应考虑由于设备磨损、包材破损等引入异物的风险,通过优化操作、维护设备等最大限度减少此类异物的引入;还可以通过定期评估特定设备生产不合格产品的趋势,按照生命周期管理的方式采取措施降低异物引入风险。
另一方面,内源性异物也可能由制剂本身或者药物与容器密封系统相互作用等引入,例如:原料药析晶产生的沉淀或降解产生的不溶性物质,药物与容器密封系统相互作用导致的玻璃脱片或侵蚀产生的异物,药物与硅油或包材浸出物相互作用产生的异物等。此类内源性异物通常在制剂放行后产生,且尺寸或数量可能随放置时间而发生变化,因此在产品开发阶段,应研究在加速或剧烈/强力条件下此类异物产生的风险,以确定异物特征以及异物产生或增长与时间的相关性,以便在稳定性考察阶段监测该类异物的变化趋势。此外,还应开发适用于表征和监测该产品特定异物的分析方法,通过优化产品处方工艺和容器密封系统,进一步减少与制剂相关的内源性异物产生。
2.3
外源性异物
通常来源于预期不会与产品直接接触的材料或环境,一般是由于生产设施条件较差导致,如环境控制不佳、设备老化、材料和人员流动等,可能存在GMP问题并引发微生物污染。因此,注射剂必须严格按照GMP的要求组织生产,避免外源性异物的引入。
研究者在确定目标产品质量概况以及建立可见异物的控制策略时除需考虑可见异物的类型外,还需考虑可见异物本身的性质(如尺寸、形状、数量、对细胞或组织的化学反应性、感染性、致癌性等)、给药途径、用药人群等临床因素以及产品剂型等,例如:静脉给药可能比皮下注射、肌内注射给药产生的不良事件风险更高,对年龄大、基础疾病患者等均可能造成不同程度的不良事件,而大容量注射剂由于给药体积较大且可能存在多日连续给药,因此受可见异物污染引发的临床风险明显高于小容量注射剂。
如果风险评估结果显示可见异物是由于处方或工艺设计不佳造成,申请人应主动应对风险,及早发现问题,优化产品处方工艺,而不是通过调整中下游工艺或严格终产品放行来达到控制产品的目的。在产品开发阶段对可见异物进行风险评估,一方面有助于理解处方工艺,为后续的持续改进奠定基础;另一方面,风险评估的结果还可以为确定生产过程中可见异物检测的警戒限和行动限提供依据,同时将识别出并经表征(包括尺寸、形状、颜色等)的可见异物作为阳性样品用于培训和检查对照。
Part
3
制定全面的检查程序是注射剂中可见异物控制的一个重要环节。注射剂中可见异物检查一般包括生产过程中100%检查与每批产品基于统计学抽样放行检查。应结合产品特性与临床风险等尽早制定可见异物检查方案,包括检查方法、统计学抽样计划、接收/拒收标准、检查结果评估标准、人员培训、设备确认与偏差调查等。不同产品以及制剂处方工艺、原辅包、批量等发生变更等时,需评估可见异物检查方案的适用性,随产品生命周期中的更新随时调整。通过可见异物检查应确保注射剂中仅存在低检测概率的异物。
3.1
生产过程中100%检查
生产过程中应采用经过验证的方法对注射剂中可见异物进行100% 检查并剔除不合格品,并应在最易检测到可见异物的工序进行检查,例如:一般应在贴标签前进行可见异物检查,以避免标签的影响。
当前,常用的可见异物检查方法包括人工灯检、半自动化检查与自动化检查;ChP 中仅收载了灯检法与光散射法[1],其中光散射法属于自动化检查范畴;EP[20],JP[14]均仅收载了灯检法。
3.1.1 人工灯检
人工灯检是通过人眼视力直接分辨异物,是目前可见异物检查最常见也是最主要的方法,各国药典均有收载。人工灯检的关键参数主要包括[16]:① 背景和对比,采用黑色或白色的纯色背景板提供对比,以最大化产品内容物的可见性。② 光照度与检查时间,需结合包装容器颜色与产品特性等选择合适的光照度,并保证每个容器都有足够的检查时间;如表1所示,对于一般透明容器,EP,USP,JP中规定的光照度与检查时间等均无明显差异,ChP中推荐光照度略低,但检查时间相应延长;对于棕色或塑料容器、混悬型注射剂等,各国药典均建议提高光照度,EP与JP还建议可以延长检查时间。③ 需仔细旋转或倒置内容物,确保容器和瓶塞内表面的可见异物得到充分检查,溶液型注射剂还应尽量避免引入气泡,以减少检测误差。
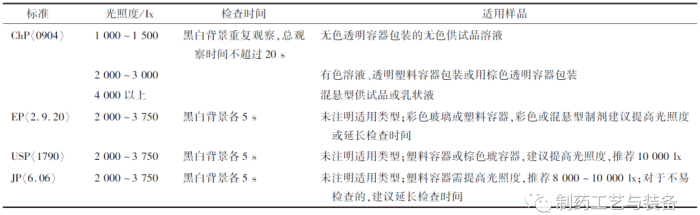
表1 各国药典注射剂中可见异物灯检法比较
人工灯检受人为因素影响较大,灵敏度相对较低,良好的培训和训练可以在一定限度上降低检查人员的变异性。ChP中明确提出,深色透明容器包装或液体色泽较深(一般深于各标准比色液7号)的品种不适合采用人工灯检法进行可见异物检查,应采用光散射法等自动化检查技术[1]。
3.1.2 半自动化检查技术
将自动化容器处理技术与人工灯检结合,在机械支持下,容器可以在检查者面前以恒定速度上下翻转或旋转,停止后检查者观察容器中的可见异物,机械或手动剔除不合格品[21]。半自动化检查技术与人工灯检工作原理相同,关键参数相似,但检查速度需经过确认,工作效率明显提高。
3.1.3 自动化检查技术
采用与半自动化检测技术相似的自动化容器处理技术,检测技术由“人工检查”发展为“自动化检查”。常见的自动化检查技术主要包括高速工业相机、可见光二极管阵列、X-射线、近场雷达、紫外和近红外光谱等,通过不同波长和传感器检测可见异物,并自动剔除。ChP中的光散射法(第二法)即利用注射剂中的可见异物使入射光发生散射的原理,通过检测光散射能量,达到检查注射剂中可见异物的目的[1]。
与人工灯检和半自动化检查技术相比,自动化检查技术不仅提高了工作效率,降低了检查变异性,还提高了灵敏度和可靠性,甚至可以检测到比目检阈值下限更小的可见异物。对许多无法采用人工灯检法检查可见异物的产品可以采用自动化检查技术,如无菌粉末、混悬型注射剂或非透明玻璃包装注射剂等。如果可见异物检查方法从前2 种方法变更为自动化检查技术,由于灵敏度提高,建议基于数据积累与统计学研究调整可见异物行动限和警戒限。自动化检查技术的缺点是设备昂贵、验证复杂、高灵敏度同时也可能会造成高误检率。
无论选择何种方法检查可见异物,都应结合产品特性对检查参数进行研究,如光照度、每个单元检查时间、检查人员疲劳时间等,根据研究结果与检查情况制定操作规程。完整的可见异物控制和监测程序,除包括可见异物检查操作规程外,还应包括生产过程控制、中间产品检查、微生物污染等操作规程,以最大限度减少可见异物的产生、识别受影响批次并协助调查可见异物来源。
3.1.4 特殊注射剂的考量[16-17]
由于制剂特性和/或包装容器等特殊性,部分产品无法采用目检法检查可见异物或方法灵敏度降低。例如:无菌粉针剂中固体粉末内容物可能掩盖可见异物、混悬型注射剂无法检出所有可见异物、大容量注射剂的包装标签以及棕色或塑料包装等均可能干扰目检。对于此类特殊注射剂通常建议增加光照度、延长检查时间、放大可见异物或采用灵敏度更高的检查方法等,使可见异物得到充分检查,USP与JP推荐光照度最高达10000 lx。部分产品由于对光较敏感而无法采用灯检法,例如:对于甲钴胺注射液,即使经过灯检短时间光照,光降解杂质也呈增加趋势,一般推荐采用灵敏度更高的自动化检查技术。
除上述措施外,还可以在100% 检查后基于统计学抽样增加破坏性补充检查,为特殊注射剂的可见异物控制提供额外保障。例如:将混悬型注射剂过滤除去固有异物后再检查、无菌粉针剂复溶后再检查、棕色或不透明容器包装的产品转移至透明容器中再检查等。当然,如果能够证明100% 检查所用的可见异物方法能够达到人工目检的灵敏度,则不需要增加破坏性补充检查。
3.2
基于统计学抽样放行检查
FDA指南草案明确在生产过程中对注射剂可见异物进行100% 检查后,还应基于统计学抽样计划,采用经过验证的检查方法及恰当的可接受标准进行产品放行检验。推荐参考ASTM E2234.22 等拟定抽样计划与可接受标准,同时还需考虑产品特性、批量大小、患者风险、可见异物类型与检测干扰因素(如难以进行可见异物检查的产品)等,对于风险较高的产品或观察到非典型缺陷的产品应制定更加严格的取样计划和可接受标准。如果采用留样样品评估市售产品(如产品由于可见异物投诉),则应将设施设备和/或该产品的历史检查数据等一并考虑在内。如果单个容器内存在多个可见异物,表明可能存在生产问题,应对该批次进行更加严格的可见异物检查。
相比之下,ChP则明确规定了可见异物检查的取样数量,注射液一般取20支(瓶),注射用无菌制剂一般取5支(瓶),并制定了明显可见异物、微细可见异物数量检出的可接受标准[1]。这与FDA指南草案[11]、USP[12] 的相关规定存在较大差异,ChP按照固定样品量进行抽样检查,未将产品批量、患者临床风险、产品特性等因素考虑在内,不仅给药品国际化生产和监管带来了极大的挑战,也难以有效、科学地控制可见异物。
3.3
培训和确认
人员培训与设备确认等对确保可见异物检查的稳健性很重要。可见异物检查人员需定期培训考核,用于可见异物检查的设备需定期验证确认,以最大限度减少不同人员或设备造成的可见异物检查结果差异。建议将工艺开发中识别出的可见异物、生产过程中或放行检验时检测到以及制备或购买的可见异物缺陷样品收集起来,与合格样品混合后用于人员培训或设备确认,培训样品总量需满足统计学要求,可见异物缺陷样品不应超过总量的10% ~20%,可见异物缺陷样品应具有代表性,且应包含目检阈值下限的缺陷样品,以确认检查灵敏度。随着生产检验过程中逐渐识别出新可见异物,可不断扩充培训和检查对照样品。
3.4
偏差调查
应对生产过程中或放行检验中检出的可见异物不合格品、上市后投诉召回的可见异物不合格品等引发的质量偏差进行调查,必要时将调查范围扩展到其他批次。偏差调查一般包括加强取样计划、调查可见异物潜在来源并评估对产品放行的影响等。通过偏差调查应尽量识别出可见异物并分类,确认发生原因的同时提出有针对性的纠正和预防措施,如优化处方工艺、改进可见异物检查程序等。偏差调查是可见异物产品生命周期管理中的重要环节,在可见异物控制策略中发挥着重要作用。
Part
4
可见异物控制开始于产品开发阶段,应持续贯穿整个产品生命周期,包括贮藏期间稳定性评价与上市后产品监控。具体研究内容涉及原辅包选择和质量控制、设施设备选择、产品开发、产品生产过程控制(如中间过程取样控制、100% 检查等)、产品放行检验、贮藏期间及临床使用中可见异物考察等,是一个不断持续的质量确认和改进过程。生产过程中的相关信息,如生产偏差、检查缺陷、设备设施故障等,可以提供生产过程中可见异物控制的状态信息、产品质量指标(如稳定性考察结果、产品投诉召回等)及产品不良反应报告可以提示与可见异物相关的产品质量问题。总之,生产过程中、贮藏及上市后的产品反馈信息,如可见异物趋势增加、出现新可见异物、超过警戒限或行动限等,一方面可以评估可见异物控制策略的有效性,另一方面也可以提示产品处方工艺设计是否存在缺陷。如果调查发现产品处方或工艺设计存在缺陷,应重新进行设计以确保产品质量可控。
Part
5
根据美国FDA指南的要求,可见异物从来源和性质分为固有异物、内源性异物和外源性异物,其产生与产品处方工艺、原辅包、生产设备等密切相关,还与注射剂的生产工艺控制和GMP实施息息相关。国内外均规定注射剂应在符合GMP的条件下生产,并在生产过程中进行100% 检查以确保可见异物符合要求。但由于可见异物来源和组成复杂,且大多具有概率性,加上目视检查方法存在的缺陷,导致生产过程中可见异物不合格率居高不下并经常出现放行后的注射剂可见异物检查不合格。
目前,国内业界对注射剂中可见异物的控制未引起足够重视,过度依赖成品检验,忽视了对可见异物的风险评估和全生命周期的管理,很少结合产品特性、可见异物特征及临床风险等制定有针对性的控制策略。目前在参照ChP标准进行生产和审评的基础上,仅成品检验结果符合药典标准规定已难以满足注射剂中可见异物的控制要求。建议结合FDA指南草案并遵循ICH Q8,Q9,Q12 等研究理念,在严格按照GMP要求进行注射剂生产的基础上,从源头把关,基于风险识别和评估,针对不同产品、不同类型可见异物建立相应的控制策略,重视过程控制,基于风险评估采用统计学抽样检验进行产品放行,根据后续反馈信息,对处方工艺与可见异物控制策略等持续改进完善,建立整体的、全生命周期管理的可见异物控制策略,确保注射剂中可见异物可控。
参考文献
[1] 国家药典委员会. 中华人民共和国药典[S]. 2020 年版. 四部. 北京:中国医药科技出版社, 2020:127 -129.
[2] 乔冲, 王慧丽, 连莹, 等. 生化药注射剂中可见异物分析方法的建立及应用[J]. 药物分析杂志, 2020, 40(9):1599 -1611.
[3] DOESSEGGER L, MAHLER HC, SZCZESNY P, et al. The po⁃tential clinical relevance of visible particles in parenteral drugs[J]. J Pharm Sci, 2012, 101(8):2635 -2644.
[4] LANGILLE SE. Particulate matter in injectable drug products[J]. PDA J Pharm Sci Technol, 2013, 67(3):186 -200.
[5] DUCHEK J, HAVASI B. Analysis of particulate matter in liquid⁃finished dosage forms[J]. PDA J Pharm Sci Technol, 2018, 72(6):608 -625.
[6] 杨平存. 葡萄糖酸钙注射液可见异物现状与浅析[J]. 安徽医药, 2015, 19(6):1205 -1206.
[7] 张敏, 翟灵妍, 张太伦. 乳酸环丙沙星氯化钠注射液可见异物问题的生产工艺优化[J]. 中国药业,2012, 21(7):22 -23.
[8] 郭艳争. 小容量注射剂可见异物影响因素分析和处理措施[J]. 当代化工研究, 2016(3):7 -8.
[9] FDA. Drug recalls[EB/ OL]. [2022 - 10 - 18]. https:/ / www.fda. gov/ drugs/ drug⁃safety⁃ and⁃availability/ drug⁃recalls.
[10] 国家药典委员会. 中华人民共和国药典[S]. 2020 年版. 四部. 北京:中国医药科技出版社, 2020:2 -5.
[11] USP. Injections and Implanted Drug Products ( Parenterals)⁃Product Quality Tests 〈1〉[S]. 2022.
[12] USP. Visible Particulates in Injections 〈790〉[S]. 2022.
[13] EP. Parenteral Preparations 〈0520〉[S]. 2022.
[14] JP. Foreign Insoluble Matter Test for Injections 〈6. 06〉[ S].2018.
[15] FDA. Guidance for Industry:Inspection of Injectable Products forVisible Particulates Guidance for Industry ( Draft Guidance)[S]. 2021.
[16] USP. Visual Inspection of Injections 〈1790〉[S]. 2022.
[17] PDA. Technical Report No. 79⁃Particulate Matter Control in Dif⁃ficult to Inspect Parenterals[R]. 2018.
[18] USP. Particulate Matter in Injections 〈788〉[S]. 2022.
[19] LEE K, LANKERS M, VALET O. Identification of particles in parenteral drug raw materials[J]. PDA J Pharm Sci Technol,2018, 72(6):599 -607.
[20] EP. Particulate Contamination Visible Particles 〈2. 9. 20〉[S].2022.
[21] 国家食品药品监督管理局药品认证管理中心. 药品GMP 指南⁃无菌药品[S]. 北京:中国医药科技出版社, 2011.
[22] 国家药典委员会. 中国药典分析检测技术指南[S]. 北京:中国医药科技出版社, 2017.
撰稿人 | 李越、董武军、张耀、王亚敏
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多