国内外制药企业质量管理成熟度现状及对我国药品生产监管的启示
Part
1
1.1
美国FDA质量量度项目
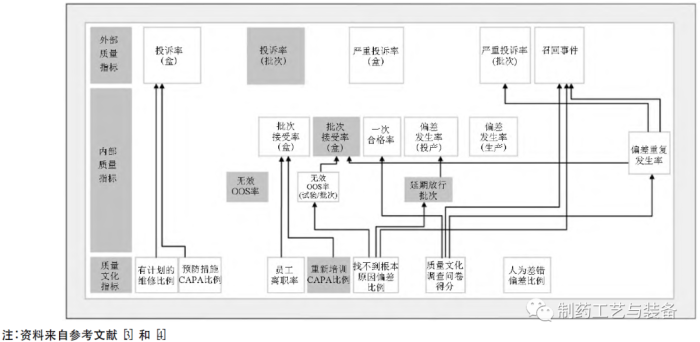
1.2
美国FDA质量管理成熟度项目
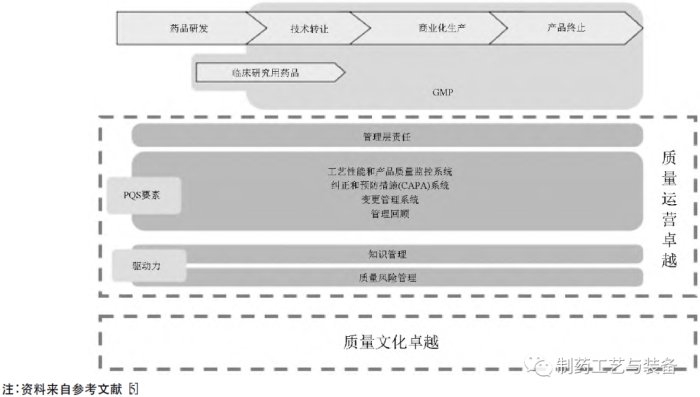
1.3
跨国制药企业质量管理成熟度


Part
2
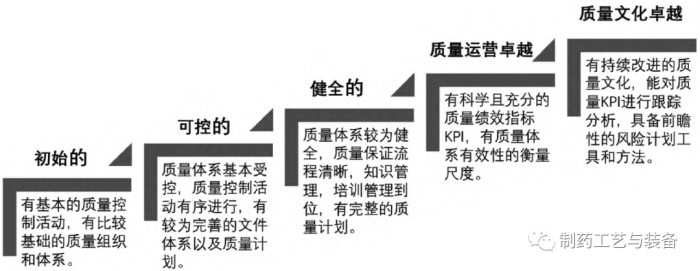
2.1
企业绩效管理中质量指标不够充分
2.2
质量管理体系的运行有效性需要提升
2.3
持续改进的质量文化建设需要加强
Part
3
3.1
转变药品生产监管理念
3.2
加强质量管理成熟度研究
3.3
智慧监管加速质量管理成熟
Part
4
参考文献
[1] International Conference on Harmonisation. Guidance on Q10 Pharmaceutical Quality System [EB/OL]. (2009-04-08) [2022-8-17]. https: / /https: / /www. federalregister. gov /documents /2009 /04 /08 /E9-7875 /internationalconference-on-harmonisation-guidance-on-q10-pharmaceutical-qualitysystem-availability.
[2] FDA. Quality Metrics for Drug Manufacturing[EB/OL]. (2022-03-09)[2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources/quality-metrics-drug-manufacturing.
[3] ISPE. Quality metrics initiative: A report from the pilot project-wave1 [EB/OL]. (2015-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-1-report.
[4] ISPE. Quality metrics initiative: Quality metrics pilot program wave 2 [EB/OL]. (2016-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-2-report.
[5] ISPE. Quality Management Maturity Program: Advancing Pharmaceutical Quality[EB/OL]. (2020-10-08) [2022-08-17]. https: / /ispe. org /pharmaceutical-engineering /ispeak /ispe-quality-management-maturity-program-advancing-pharmaceutical.
[6] FDA. CDER Quality Management Maturity[EB/OL]. (2022-05-04) [2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources /cder-quality-management-maturity.
[7] ISPE – PDA Guide to Improving Quality Culture in Pharmaceutical Manufacturing Facilities[EB/OL]. (2019-10-07) [2022-08-17]. https: / /ispe.org /news /ispe-pda-create-guide-improving-quality-culture-pharmaceutical-industry.
[8] 国家药品监督管理局. 国务院办公厅印发《关于建立职业化专业化药品检查员队伍的意见》[EB/OL] . (2019-07-18) [2022-08-17]. https: / /www. nmpa. gov. cn /yaopin /ypjgdt /20190718174601792. html.
[9] 国家药品监督管理局. 国务院办公厅印发《关于全面加强药品监管能力建设的实施意见》[EB/OL] . (2021-05-10) [2022-08-17]. https: / /www.nmpa. gov. cn /zhuanti /ypjgssyj /ypjgssyjjj /20210510191205129. html.
[10] 国家药品监督管理局. 国家药品监督管理局启动药品检查合作计划(PIC/S) 预加入申请工作[EB/OL] . (2021-09-29) [2022-08-17]. https:/ /www. nmpa. gov. cn /yaopin /ypjgdt /20210929162552105. html.
[11] Steven Lynn,Susan Schniepp,Justin Anahory. Getting drug quality right thefirst time [EB/OL]. (2022-04-20) [2022-08-17]. https: / /www. pharmamanufacturing.com/articles /2022 /getting-drug-quality-right-the-first-time /.
[12] 王霞,陈恒青,朱建伟. 质量管理体系中实施质量量度对制药工业的意义[J]. 中国医药工业杂志, 2020,51(4) : 545-550.
[13] 包敏芝,胡延熹. 质量量度在国内药品生产企业中的应用[J]. 上海医药, 2016, 37(23) : 69-72.
[14] 国家药品监督管理局. 中华人民共和国药品管理法[EB/OL]. (2019-08-27) [2022-08-17]. https: / /www. nmpa. gov. cn /xxgk /fgwj /flxzhfg /20190827083801685. html.
[15] 张景辰. 加强事中监管,促进药品产业的供给侧改善—FDA 质量量度计划的启示[J]. 中国食品药品监管, 2016,(4): 56-58.
[16] 杨依晗,赵燕君,高惠君. 美国食品和药物管理局质量量度管理的简介及启示[J]. 中国新药与临床杂志, 2016, 35(4) : 260-263.
[17] 孙敏,谭德讲. 用合理的质量量度指标助力药品质量的科学监管[J]. 中国食品药品监管, 2021,(2) : 37-43.
撰稿人 | 胡位歆、和金周
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
几种典型制药工艺流程图分析
2025-10-11
-
阿司匹林合成工艺及装置改进
2025-10-21
-
辐照辐照灭菌技术在制药行业中的应用灭菌技术在制药行业中的应用
2025-10-11
-
中药颗粒剂生产中的现代化工艺改造
2025-11-04
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
2025年50家头部药企的竞争格局与核心趋势分析
2025-10-21
-
一文看懂新药研发到上市的全流程
2025-11-25
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多