20周年特辑 | 偏差管理在药品研发质量管理体系中的应用

正是因为对偏差的认识不足,目前研发机构的偏差管理非常混乱,有些机构缺少偏差管理程序,即使有偏差产生也没有认识到;有些机构虽然起草了偏差管理的SOP(标准作业程序),但是在执行层面上仍然对偏差处理存在困惑。这些问题导致药品研发机构的偏差管理既不能满足法规监管的要求,也无法发挥偏差作为质量管理体系改进工具的作用。对此,本文接下来将对偏差管理的特点、实施流程及常见问题等进行探讨,为药品研发人员提供思路。

01
偏差管理的意义
1.1
提高人员技术水平、增加技术和经验积累
1.2
改变和提升管理理念
1.3
标本兼治、降低成本
偏差调查是查找根本原因并彻底纠正的过程,在调查时不允许浅尝辄止,纠正时不能“头痛医头脚痛医脚”,这种以终为始的工作思路能够有效地防止类似问题不再发生,显著降低企业成本。

02
研发偏差的特点
2.1
定义
2.2
适用范围
2.3
人员职责和资质
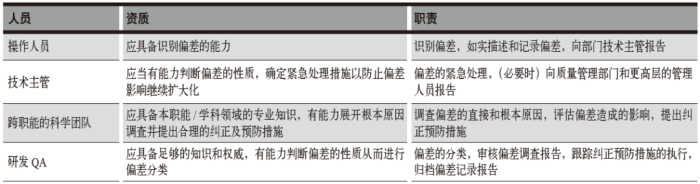
表1 人员资质及职责要求

03
研发偏差实施流程和关键控制点
3.1
实施流程
3.2
关键控制点
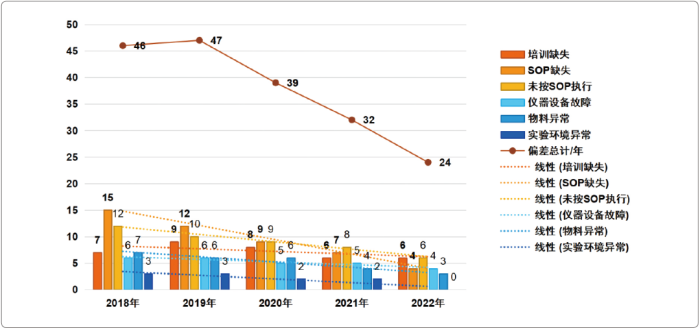
图1 某研发系统趋势分析统计
(5)最后,折线图直观呈现了该研发系统自2018年至2022年每年的偏差数量逐年降低,说明该研发系统质量管理能力及管理效果逐年提升。

04
偏差常见问题及原因分析
4.1
实施过程中存在的问题及分析
4.2
调查报告书写中存在的问题及建议
一致性:在整个报告中同一名称的专业称呼要保持一致,并与法规或SOP中的用词一致,不要使用方言或俗语;结论与分析结果、因果关系、支持理由、逻辑等要保持一致;数据和图表最好采用一致的格式。

05
总结
参考文献
[1]国家食品药品监督管理总局.关于开展药物临床试验数据自查核查工作的公告[EB/OL].(2015-07-22).https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20150722173601172.html.
[2]国家药品监督管理局.仿制药质量和疗效一致性评价研制现场核查指导原则[EB/OL].(2017-05-18).https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20170518144401598.html.
[3]中共中央办公厅,国务院办公厅.关于深化审评审批制度改革鼓励药品医疗器械创新的意见[EB/OL].(2017-10-08).http://www.gov.cn/zhengce/2017-10/08/content_5230105.htm.
[4]全国人民代表大会常务委员会.中华人民共和国药品管理法[EB/OL].(2019-08-27).https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20190827083801685.html
[5]汪达,张宝月,龙华燕.药品生产偏差管理讨论[J].化工与医药工程,2019, 40(04):61-64.
[6]厉洁,黄浩.药品生产的偏差调查与分析[J].内蒙古中医药,2012,31(06):66-68.
[7]国际人用药品注册技术协调会.药物质量体系 Q10[EB/OL].(2008-06-04)https://www.cde.org.cn/ichWeb/guideIch/toGuideIch/1/0.
[8]国际人用药品注册技术协调会.活性药物成分(API)的GMP指南 Q7[EB/OL].(2000-11)https://www.cde.org.cn/ichWeb/guideIch/toGuideIch/1/0.
[9]国家食品药品监督管理局药品认证管理中心.药品GMP指南 质量管理体系[M].北京,中国医药科技出版社,2011:2.
[10]中华人民共和国卫生部.药品生产质量管理规范(2010年修订)[EB/OL].(2011-01-17).https://www.gov.cn/gongbao/content/2011/content_1907093.htm.
[11]乔晓芳.浅析药品生产偏差管理进展及改进措施[J].流程工业,2018(04):24-27.
[12]国家药品监督管理局.国家药监局关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告(2022年第43号)[EB/OL].(2022-05-27).https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20220527182006196.html.
[13]尚海宾.浅析药品生产设备清洁风险管理[J].流程工业,2016(07):49-50.
[14]乔晓芳,杨胜亚,王志超.药品生产质量风险管理现状分析及改进措施[J].化工与医药工程,2019,40(02):53-58.
[15]谭宏宇,单化峰,等.FTA法与FMECA法在药品质量偏差调查中的应用[J].中国药房,2016,27(31):4325-4328.
[16]尚海宾.小容量注射剂干燥及包装生产质量风险管理[J].流程工业,2016(19):48-50.
[17]刘知音,赵红菊.药品生产偏差管理现状调研及分析[J].中国药房,2011,22(01):1-4.
撰稿人 | 邵玲、叶刚
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
几种典型制药工艺流程图分析
2025-10-11
-
阿司匹林合成工艺及装置改进
2025-10-21
-
辐照辐照灭菌技术在制药行业中的应用灭菌技术在制药行业中的应用
2025-10-11
-
中药颗粒剂生产中的现代化工艺改造
2025-11-04
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
2025年50家头部药企的竞争格局与核心趋势分析
2025-10-21
-
一文看懂新药研发到上市的全流程
2025-11-25
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多