国药入主,一知名药企实控人生变
卫光生物实控人拟变更
国药集团入局
近日,深圳市卫光生物发布《关于控股股东、实际控制人拟发生变更暨股票复牌的提示性公告》,6月2日,光明国资局与中国生物签署了《合作协议》,约定光明国资局与中国生物拟设立合资公司,光明国资局持有合资公司49%股权,中国生物持有合资公司51%股权。

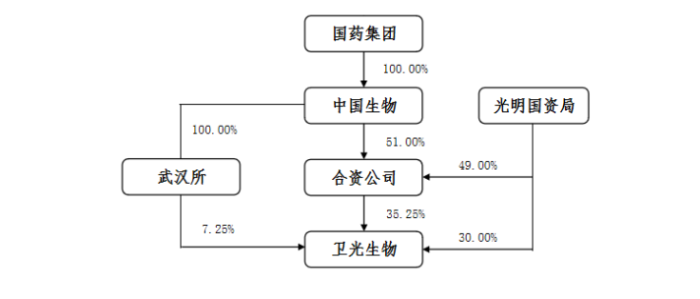
合资公司设立后,卫光生物的实控人将发生变更。
光明国资局向合资公司无偿划转7994.7万股股份,占其总股本的32.25%。合资公司直接持有卫光生物32.25%的股份,成为卫光生物的控股股东,中国生物通过合资公司和武汉生物制品研究所控制卫光生物42.50%的股份,卫光生物实际控制人由光明国资局变更为国药集团。
具体来看,本次无偿划转完成前,其控制权关系,如下:
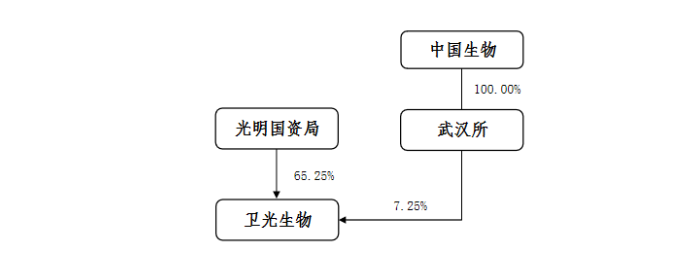
本次无偿划转完成后,其控制权关系,如下:
接下来,卫光生物将加入“国药系”。
卫光生物主要从事血液制品的研发、生产和销售,产品包括人血白蛋白、静注人免疫球蛋白等共9个品种21个规格。在去年12月份期间,静注人免疫球蛋白这类药曾遭到“疯抢”。2022年,卫光生物营收6.68亿元,同比下滑26.39%,净利润1.17亿元,同比下滑42.83%;2023年第一季度,卫光生物营收约2.09亿元(同比增长51.34%)、净利润约4574万元(同比增长80.54%)。
德邦证券在一份研报中指出,血制品具备资源品+高壁垒属性,具有长期投资价值。血制品行业进入门槛极高,自2001年起国内不再新批血制品生产企业,仅有存量的少部分玩家,且近几年行业整合趋势愈发明显。同时,血制品具备资源品属性,上游的采浆量天然存在限制,较高的进入门槛以及资源品属性构建了行业的长期壁垒。
国药集团旗下中国生物拥有丰富的血液制品资产,其控股上市公司天坛生物拥有成都蓉生、上海血制、武汉血制、兰州血制、贵州血制、国药西安5家血液制品生产企业,国药集团此前控制的血液制品牌照已经有6家。本次拿下卫光生物的实际控制权后,中国生物控制的血液制品牌照增加至7家。
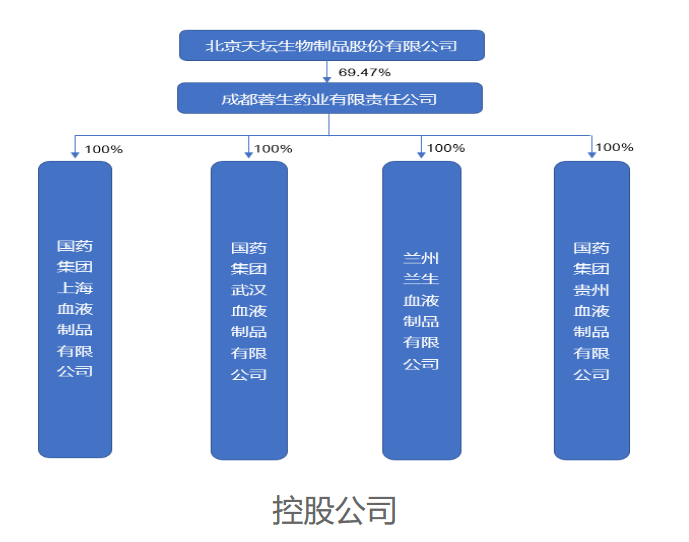
截图来源:天坛生物官网
北京天坛生物是国内血制品的头部企业,共计拥有人血白蛋白、人免疫球蛋白、人凝血因子等三大类、14个品种、72个血液制品生产文号(统计截至2022年年末)。未来,天坛生物与卫光生物如何整合发展,仍是业内关注的重点。
行业龙头“强势”布局血制品
冲击高壁垒行业
近年来,血制品行业的认可度不断得到提升,行业集中度也在持续加强。
血液制品行业壁垒坚固、市场准入条件较高;同时,血液制品拥有一定的技术和资金壁垒,其生产主要成本来自于原料血浆和产品研究,生产企业如果想要降低单位成本以提高竞争力就必须提高血浆的综合利用率,在血浆采集、产品研发、临床试验、产品生产到产品实现销售,需要投入大量的资金及设备等。
拥有特殊属性的血液制品,其价格也一直保持稳定。虽然集采已经常态化,但对其价格体系的影响并不大。例如,广东联盟集采中,静注人免疫球蛋白(pH4)、人免疫球蛋白、人凝血因子VIII、人纤维蛋白原、人血白蛋白5个血制品均有企业中选,总体来看,降幅均较小。
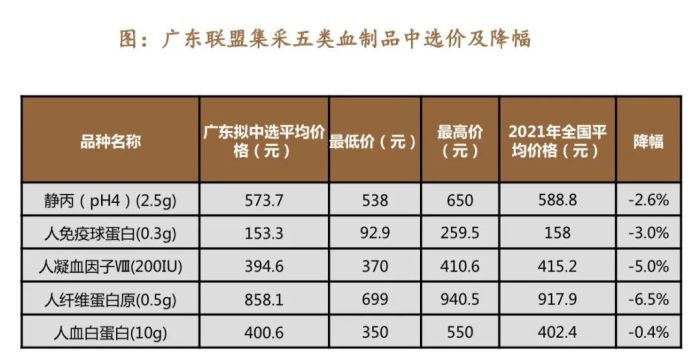
图片来源:德邦证券
根据《中国血制品行业发展深度研究与投资趋势分析报告(2023-2030年)》,“十四五”期间国家对新建浆站有望逐渐放开,血制品行业有望迎来采浆供给增量新时期,预计2025年中国血制品市场规模达500亿元,整体市场未来成长空间广阔。
广阔的市场发展空间及系列优势下,早已吸引不少行业巨头布局血制品。
日前,华润医药以累计近48亿元入主博雅生物,成为其控股股东,中国华润有限公司成为其实际控制人,国务院国有资产监督管理委员会成为其最终实际控制人。
博雅生物主要业务覆盖血液制品,拥有多个血液制品产品,包含静脉注射人免疫球蛋白等,并且,博雅生物血液制品业务研发管线完备,在研产品主要包括人凝血因子Ⅷ、人凝血酶原复合物等。
在完成合并后,尤其在血液制品领域,博雅生物业绩增长明显。
2022年,博雅生物营收27.59亿元,同比增长4.08%;实现归属于上市公司股东的净利润4.32亿元,同比增加25.45%。博雅生物在业绩报告中称,其主要产品销量增长、产品毛利率增加、理财收益增加等综合因素带来净利润较大增幅。其中,血液制品业务实现营业收入13.42亿元,同比增长8.96%;血液制品业务实现净利润4.98亿元,同比增长29.45%。
华润医药对血液制品未来发展看好明显,其曾表示,血液制品行业壁垒较高,随着中国血液制品上市品类逐步增多以及临床认知度提高及适应症拓宽,未来国内血液制品行业将保持稳健增长。
如今,国药集团再次深入血液制品赛道,接下来的发展或许也会给更多企业带来参考。
END
编辑 | 遥望
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多