正交试验优选板蓝根片提取工艺
板蓝根片由板蓝根、茵陈、甘草[1]三味中药材加水提取、浓缩稠膏,加辅料制粒、干燥,加润滑剂总混、压片而成[2-3],有着清热解毒、除湿利胆的功效,适用于感冒发热、咽喉肿痛和肝胆湿热的症状。本次研究以L9(3)4正交试验的方法,对板蓝根、茵陈、甘草的提取时间、溶媒用量、提取次数等工艺进行优选,为板蓝根片的制剂生产提供数据支持。
1 实验材料
1.1设备
设备:万能粗碎机、索氏提取器、HH-S型数显水浴锅、电加热套、旋转蒸发仪、循环水式多用真空泵(上海和杰科技有限公司)、TD-100型多功能微型提取浓缩机组。
1.2 原辅料
中药材:板蓝根、茵陈、甘草;药用辅料:羧甲淀粉钠、蔗糖、玉米淀粉、硬脂酸镁。本次实验所用到的原辅料经检验均符合质量标准。
2 方法与结果
2.1 提取工艺因素水平确定
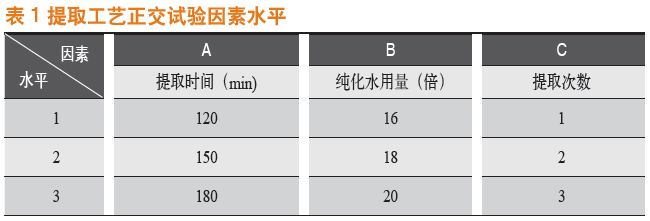
称取中药材板蓝根300 g、茵陈150 g、甘草50 g(可制成1 000片板蓝根片),挑选后经粒径为0.5 cm的万能粗碎机粗碎,置索氏提取器进行提取。提取液分别通过真空减压浓缩。选择提取时间(A)、纯化水用量(B)、提取次数(C)3个影响因素,每个因素设3个水平为考量指标。因素设计见表1。
2.2 实验方法与结果
采用L9(3)4正交表对试验进行分析,以板蓝根片提取的浸膏收率为考察指标。试验安排及结果见表2,浸膏收率方差分析结果见表3。
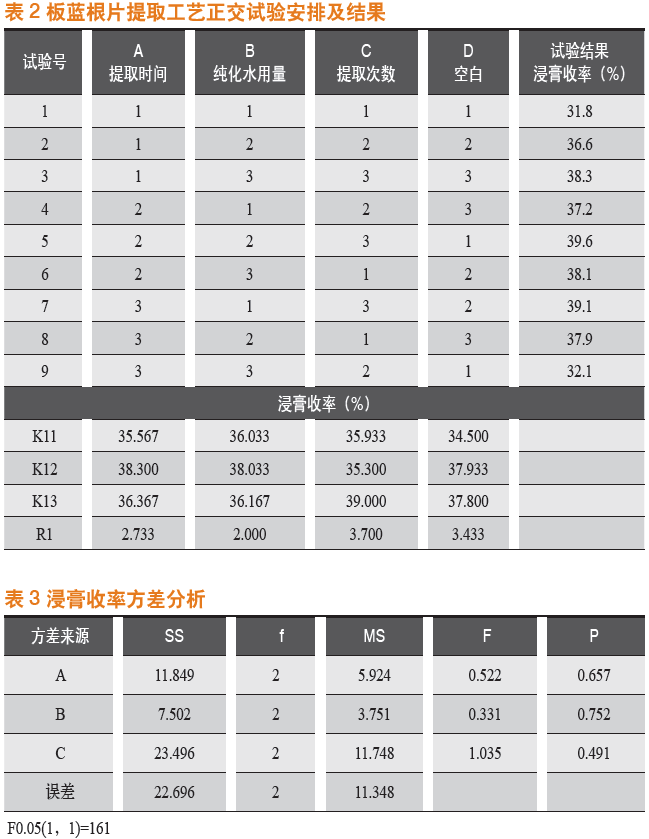
从正交试验结果和方差分析得知:各因素、水平之间无显著差异,影响最大的因素为C,因素主次顺序为C>A>B。最佳提取工艺为A2B2C3,即提取时间为150 min、纯化水用量时间为18(倍)、提取3次,浸膏收率高。
2.3 结果分析
优选的提取工艺为:提取时间为150 min、纯化水用量为18(倍)、提取3次,浸膏收率量高。结合小试实际情况,同时结合降低工时、节约能源综合考虑后,调整最佳提取工艺为:第一次饮用水用量为8倍量,提取时间为60 min;第二次饮用水用量为6倍量,提取时间为30 min;第三次饮用水用量为4倍量, 提取时间为30 min,进行中试验证实验。
2.4 中试验证实验
2.4.1 提取中试工艺验证
按以上拟定的提取工艺:第一次饮用水用量为8倍量,提取时间为60 min;第二次饮用水用量为6倍量,提取时间为30 min;第三次饮用水用量为4倍量,提取时间为30 min,进行3次中试验证实验。每次实验用到的板蓝根片数量为10 000片(即所需原辅料:中药材板蓝根3 000 g、茵陈1500 g、甘草500 g),挑选后经粒径为0.5 cm的万能粗碎机粗碎,置多功能微型提取浓缩机组,进行提取、减压浓缩。
2.4.2 合格标准
浸膏密度:(热测)1.2±0.02。
浸膏收率:浸膏收率不低于30%。
浸膏粉鉴别:板蓝根供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点;茵陈供试品色谱中,在与对照药材色谱相应的位置上,显相同的蓝色荧光斑点。
2.4.3 检测结果对比
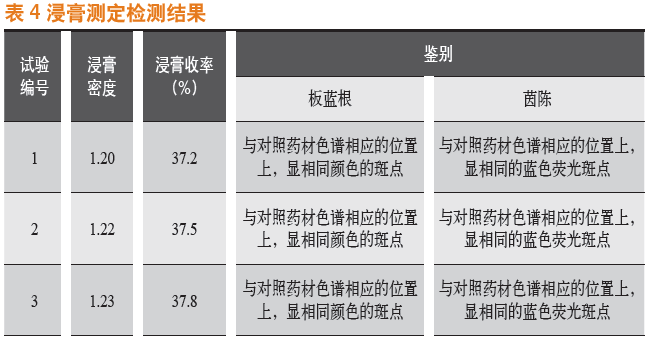
3次中试实验中,每次取样对浸膏密度、浸膏收率进行检查,对浸膏粉的板蓝根鉴别、茵陈鉴别进行检查,数据统计结果见表4。
通过浸膏测定检测结果对比得出:板蓝根片提取的浸膏密度、浸膏收率和板蓝根鉴别、茵陈鉴别均符合质量标准。这表明优选的板蓝根片的提取时间、纯化水用量、提取次数等提取工艺参数重现性好,中试工艺稳定。
2.5 制粒、压片工艺研究
中试提取浸膏粉、羧甲淀粉钠、玉米淀粉、蔗糖粉,置槽型混合机干混5 min,加入70%乙醇,混合5 min制软材过14目制粒,将湿颗粒置烘箱低温(≤50℃)干燥,干燥3~6 h后进行烘干,此时的物料厚度约为1.0~3.0 cm,干燥过程每1 h翻盘1次,加入硬脂酸镁5 g,总混30 min,压制成1 000片,并控制片重。
2.5.1 合格标准
颗粒水分:1.5%~3.5%。
片重差异:0.35 g±5%
崩解时限:应在45 min内全部崩解
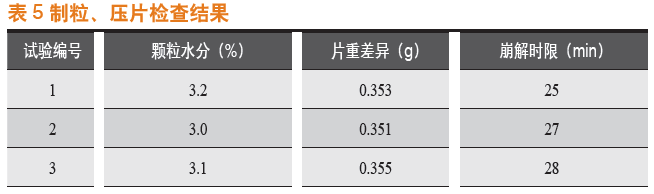
2.5.2 制粒、压片检查结果
制粒、压片检查结果见表5。
通过制粒、压片检查结果对比得出:由中试提取工艺生产出的浸膏粉,在用于后续的制剂生产过程(板蓝根片的制粒、压片工艺生产过程)中稳定性良好,产品的颗粒水分、片重差异和崩解时限等各项检查均符合质量标准要求,检查数据重现性好。
3 结果与讨论
本次工艺研究优选的板蓝根片提取工艺节约了能源,降低了生产成本。关键工艺参数提取时间、溶媒用量、提取次数和浸膏的收率数据重现性好、操作简便;关键质量属性浸膏粉的板蓝根鉴别、茵陈鉴别检验数据以及产品的颗粒水分、片重差异、崩解时限等各项检查均符合质量标准要求,中试工艺稳定,为板蓝根片的制剂生产提供了重要的数据支持。
【参考文献】
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2020:214、250、88.
[2] 国家药典委员会.中华人民共和国药典(四部)[S].北京:中国医药科技出版社,2020:791、630、823、766.
[3] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2020:1110.
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多