注射剂一致性评价关键技术要点

2017年10月8日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》。2017年12月22日和2018年3月14日,国家食品药品监督管理总局药品审评中心相继发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》和《药物注射剂研发技术指导意见》的通知。业内期待已久的注射剂一致性评价正式启动。
2019年10月15日,国家药品监督管理局综合司再次公开征求《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》意见,关于注射液一致性评价的技术要求更加明确。
《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》中,对注射剂一致性评价的总体要求、参比制剂、处方工艺、原辅包质量控制、质量研究与控制、稳定性等各个方面做出了较为详细的技术要求和指导。其中,关于包材的选择与研究最为核心的要求是:注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致。
依据以上指导原则,未要求注射液包装材料必须与参比制剂相同,包材的选择重点是为了保证产品质量与参比制剂一致,包材的性能不低于参比制剂,达到保证产品质量稳定的目的。
1 玻璃安瓿和玻璃小瓶
根据BEROE的市场调查报告[1],安瓿和玻璃瓶在非胃肠道给药包装中占最大的市场,高达70%以上。在过去几年里,玻璃分层脱片,以及市售药品中可见和亚可见的薄片颗粒物的问题大大增加,导致了许多召回事件,如:注射用夫西地酸钠(立思丁)产品的玻璃瓶内发现玻璃碎片,少量甲氨喋呤注射液产品的药液内存在玻璃碎屑,Hospira公司的卡铂、阿糖孢苷、紫杉醇等系列产品出现可见异物。以上召回事件的主要原因在于包材脱片产生玻屑,然而其他许多的召回事件如稳定性留样检验不合格,也与包材有一定的关系。
实际上,分层是玻璃表面化学侵蚀的结果,除了导致形成玻屑脱片之外,还可以产生与药物制剂的相互作用以及药物功效的降低影响,甚至会出现玻璃元素浸入制剂中引起不可预测的副作用,比如某些生物制品的蛋白质吸附会导致其货架期缩短,又或者玻璃浸出的金属离子会影响未缓冲药物制剂的pH值,导致稳定性下降,从而导致治疗功效的下降。
玻璃包材中发生的化学反应取决于许多因素,包括玻璃包材的类型、玻璃的组成、药液pH值范围、化合物性质、储存时间和温度、包材的生产工艺以及灭菌过程,即使仅改变一个变量,也会影响玻璃表面的性质。玻璃通过离子交换(酸性药物制剂)和溶解(碱性制剂)被水侵蚀。离子交换使得水浸入玻璃,导致玻璃中的碱离子被交换释放进入药液中,碱性制剂的溶解是通过氢氧根分解硅酸盐的主链,两种机制都可轻易导致玻璃表面分离出浸出层。即使pH值偏中性的制剂也会与玻璃发生效应,比如某些用磷酸盐缓冲液配制的药物,其中的磷酸盐会与玻璃反应,形成易剥落的浸出层。
玻璃成分和制造工艺会影响玻璃表面抵抗与药液相互作用的能力。与国内指导原则相同,美国、欧洲所有注射制剂必须储存在I型玻璃容器中[2],并满足耐水性的要求。即使这样,来自不同制造商的I型玻璃的成分也可能有很大差异。
关于成型工艺,模制瓶的制作过程为一步高温工艺,该工艺导致玻璃表面具有较高的碱性物质,而管制瓶则分两步成型,通常是由硅含量较高的玻璃制成的。一般情况下管制瓶比模制瓶更耐化学腐蚀。以下我们将从玻璃成分以及制造工艺方面浅析对药物制剂的影响。
(1)玻璃瓶成分对产品质量的影响
参考ISO 12775:1997分类方法,根据三氧化二硼含量和平均线热膨胀系数的不同将玻璃分为硼硅玻璃和钠钙玻璃,本处仅讨论中硼硅玻璃。通常药用玻璃包含二氧化硅、三氧化二硼、三氧化二铝、氧化钠、氧化钾等成分,每种比例在一定范围内波动,不同的制造商的配比也不相同。表1列出的是国外某公司药用玻璃成分[3],玻璃类型均符合欧美药典和ASTME-438的I型玻璃容器标准。
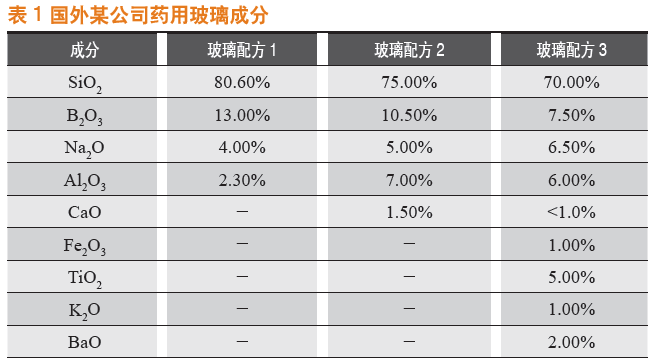
玻璃中不同的组分含量可对药物制剂的稳定性产生影响,比如配方3中的三氧化二铁。对于光敏感的制剂,包材的选择可考虑遮光容器来减小光照带来的影响,常规的遮光包材如棕色的玻璃容器,是加入铁、锰、钛等过渡金属氧化物形成着色玻璃以产生遮光效果。
对于金属离子敏感的制剂,棕色包材往往会影响成品的有关物质。例如,某盐酸注射液对光和金属离子均敏感,表2为采用相同的药液、不同的包材筛选出的研究数据,不同包材均来源于同一包材厂家。研究数据可见,棕色玻璃安瓿的批次与其他批次相比,灭菌后,有关物质较大,稳定性更差。
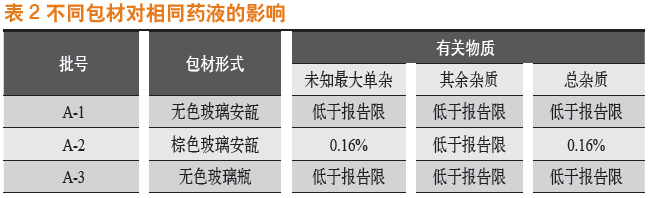
对于以上类型问题的建议是选择不含三氧化二铁等氧化成分的包材,采用包材外部覆膜方法阻隔光线接触药液。比如采用玻璃小瓶盛装的某注射剂,FDA原研说明书中提到,该药品所采用的西林瓶外有一层覆膜,该膜为避光保护膜,材料是PET膜,可解决金属离子敏感的问题。
玻璃的成分还影响玻璃的分层脱片,使药物制剂产生可见异物问题。美国康宁公司研究表明,虽然中硼硅玻璃比传统玻璃呈现较好的性能,但还是存在分层脱片问题,而玻璃脱片的根本原因在于硼。在玻璃管加工小瓶过程中,小瓶底部切割会导致硼元素和钠元素的蒸发,引起脱片问题。
这也是某些特殊产品与硼硅玻璃存在相容性问题的原因。解决这种特殊产品相容性问题的方法之一是使用无硼的含硅铝酸盐配方的玻璃材质,与硼硅酸盐相比可消除分层,且对于浓度小的药液具有稳定作用。图1为硼硅玻璃和铝硅玻璃烧制样图。图中可明显观察到不同玻璃成分在烧制过程中会导致玻璃表面附着的金属离子不同,进而影响产品质量。

(2)玻璃瓶制备工艺对产品质量的影响
中硼硅玻璃含硼量较大,有的配方铝含量较多,在玻璃融化过程中面临着粘度大,熔化温度较高等问题。由于对成型的玻璃管材尺寸要求严格,其玻璃气泡含量,玻璃溶体的化学均匀性,温度均匀性要求较高。国内外多采用全氧燃烧电助熔辅助工艺,配合丹纳法或维罗法拉管成型。表3为国外玻璃生产厂商的制作方法[4]。
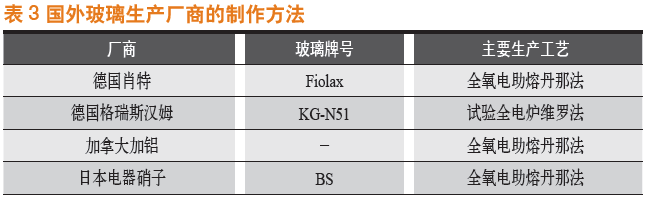
国内厂家由于旋转管等管材质量不稳定,基本进口德国肖特、美国康宁、日本NEG等公司的玻管进行后加工处理,后加工处理包括成型和覆膜工艺。管制瓶的成型工艺大致分为加热、拉伸、退火、切割、二次退火、冷却,其中加热温度、时间,拉伸力度、机器运行速度以及退火温度和切割速度均会影响成型质量,同时安瓿生产方向(立式/卧式),生产线与玻璃厂家的选择相关。
成都苑东生物制药股份有限公司正在研究的一个注射液产品易氧化,pH值稳定性差,在包材厂家的筛选试验中显示同一管材不同厂家对制剂影响明显不同,如表4所示。
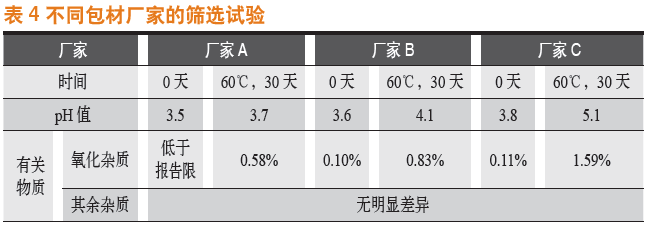
除了成型工艺外,生产厂家还可以对玻璃内壁进行覆膜。对包材内部进行涂层覆膜是一种有效解决药液与包材相互作用的方案。
目前市面上可提供各种覆膜用以改善药用玻璃的耐化学性。比如在退火步骤之前将硫酸铵喷入玻璃内侧,以降低玻璃表面的碱度。或使用薄石英(SiOx)涂层来抑制水扩散。特别对于生物制品,均匀的二氧化硅膜可以有效地阻止API与玻璃表面之间的相互作用,从而最大程度地减少API的吸附并延长保质期。有玻璃制造商采用等离子脉冲化学气相沉积(PICVD)将几层二氧化硅分子(厚度为100~200 nm)附于玻璃瓶的内表面。这种膜不影响小瓶的尺寸,可以提供有效的屏障以防止水的扩散。据该公司称经过检测验证,该涂层覆膜可减少放射性诊断产品和蛋白质的吸附,提高包装材料的耐化学性和稳定性,此外它还可以降低离子从玻璃表面的浸出率小于检测水平。
另一种是用于药物小瓶的疏水涂层,该涂层也可通过PICVD进行涂覆。疏水涂层的表面光滑,非常适合冻干产品以延长其保存期限。带有疏水涂层的小瓶的表面均匀,可防止冻干成分粘附到瓶的内壁。使用这种玻璃瓶的冻干产品具有良好的外观,并能在水中更快地重新溶解。同时另一个好处是,抽取时几乎没有药物制剂残留在小瓶中。使用传统的药用容器时,有10%~20%的成分会粘附在粗糙的玻璃内表面上,药品生产商须增加药液填充量,确保可抽取体积合格。当使用带有疏水涂层的小瓶时,过量填充量可大大减少,从而节省大量成本。
另外,由欧盟资助的项目“高性能玻璃态系统的粘附力和内聚力”(ADGLASS)是一种新型的涂层技术,可以改变与玻璃材料的界面,以减少对药液的影响。通过量子建模技术,开发蛋白质在氧化物(二氧化硅和二氧化钛)与水之间的界面的原子吸附模型,以及模拟玻璃薄层的机械和化学机械性能裂纹扩展界面。结合理论评估进行实验研究,创建了聚乙二醇(PEG)类抗粘等离子体涂层,覆于药用玻璃小瓶内壁。与参考样品瓶相比,PEG类涂层明显降低吸附,最高可达20倍以上的吸附降低。
在使用覆膜玻璃容器同时需考虑涂层与药液的影响以及自身的降解,图2为涂层发生的降解[5]。
2 胶塞
橡胶塞在国内制药行业应用广泛,作为药品包装常用的橡胶按材料划分主要有:聚异戊二烯橡胶、丁基橡胶及卤化(溴化/氯化)丁基橡胶等;按工艺划分主要有:覆膜工艺、涂膜工艺和镀膜工艺等。橡胶成分复杂,通常包括生胶、硫化体系(硫化剂、硫化促进剂、硫化活性剂),补强剂、填充剂、软化剂等,因此在使用过程中,经常与药品发生作用,导致样品关键质量属性发生变化,影响产品安全有效性。在此,我们围绕胶塞对注射剂的CQA的影响进行讨论,为大家在日常选择胶塞时提供一些参考。
(1)对产品水分的影响
冻干产品的水分控制是产品的关键,冻干水分的控制包含冻干工艺对于水分的控制以及冻干产品稳定性期间的水分增长的控制。冻干工艺对于水分的控制一般容易达到,但贮存期间水分的增长影响因素较多。通常冻干产品贮存期间水分的增长伴随着有关物质的增长,所以水分的控制非常关键。不同胶塞配方和不同胶塞处理方式,均会导致产品在稳定性期间水分的变化差异以及稳定性差异。
例如,成都苑东生物制药股份有限公司研发的另一个注射用产品对水分非常敏感,在冻干出箱后检测水分仅1.4%左右,60±2℃条件下考察10天,水分升至2.5%左右,逼近限度3.0%,有关物质水平已超出标准规定。我们研究了不同厂家胶塞及胶塞的不同处理方式对产品的影响,使用不同厂家的胶塞及不同方式处理的胶塞制备样品,考察了样品的水分变化情况。具体结果见表5。
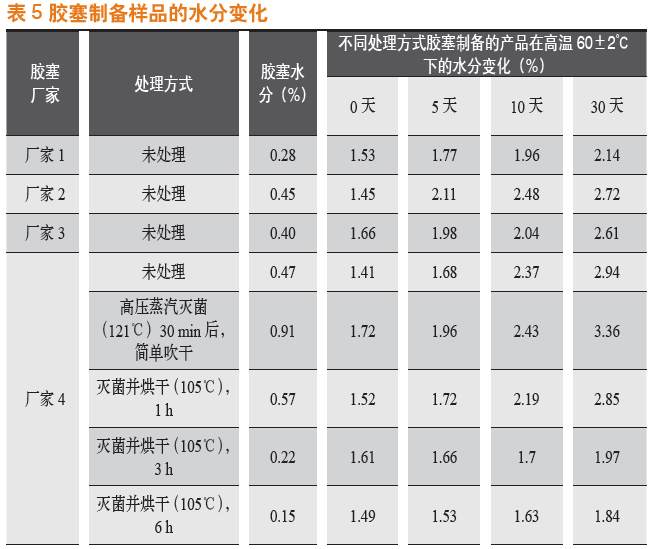
结果显示不同厂家的胶塞之间水分有明显差异,制备的产品稳定性也有较大的差异;就胶塞本身而言,经过蒸汽灭菌后,水分显著升高,胶塞的水分随着干燥时间的增长,变得越低。胶塞水分越低的产品在放置考察中,水分的增长趋势越缓,产品的有关物质也控制在规定范围内,没有超出限度。通过延长胶塞清洗灭菌后的干燥时间严格控制胶塞的水分,得到了质量稳定的产品。
胶塞的水分与胶塞本身的配方有密切关系,胶塞配方众多,其卤化形式主要有氯化和溴化,已有胶塞厂家证明,不同配方的胶塞测出的残留水分不同,4种配方胶塞的水分测定结果为丁基1(无氯化)<溴化=氯化<丁基2(无氯化)。目前国外有较多冻干使用了半覆膜/全覆膜胶塞,所用的膜材料一般具有较强的耐水蒸气透过性,可用于水分敏感的冻干制剂中。
(2)对产品含量的影响
在研究过程中,我们需要关注低剂量注射液产品研发中胶塞对主药的吸附。有文献报道,盐酸胺碘酮的5%葡萄糖溶液在玻
璃瓶内,加橡胶塞放置一段时间后,接触橡胶塞的药液浓度减少了10%~14%,不接触的未见下降。Burrell在试验中观察到纯乳胶橡胶可以吸附溶液中的苯酚、三氯叔丁醇、氯化甲酚等[6]。
在另外一个注射液研发中,成都苑东生物制药股份有限公司选用国内某厂家的氯化丁基胶塞,进行小试研究时发现,产品按照处方量进行配液后灌装前药液含量结果合格,但经过灌装、灭菌后检测成品含量减少约10%,而产品的有关物质并无明显升高。我们取来三个厂家的西林瓶及三个厂家的胶塞进行了对比研究。结果见表6。
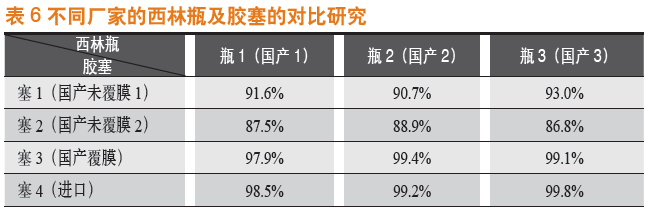
我们发现使用国产覆膜胶塞和进口胶塞制备的成品含量没有降低,其余样品含量降低严重。不同厂家的胶塞之间,配方、加工工艺均有差异,导致胶塞对产品的吸附有较大差异。
(3)对产品不溶性微粒和可见异物的影响
导致产品不溶性微粒不合格的因素主要有,表面硅油量过大、药品pH值、胶塞内部迁移的物质等。
胶塞中加入了大量附加剂,如促进剂B-硫基苯骈噻唑、二硫化四甲基秋蓝姆、防老剂N-苯基B萘胺、填充剂氧化锌、碳酸钙及硫化剂等,胶塞与内容物接触后,其中一些物质迁移进入产品,使药液出现异物或浑浊。如头孢唑林钠粉针,卫生部抽检药品时发现许多厂家生产的头孢唑林钠粉针的澄清度不合格,杨华山进行了丁基胶塞对头孢唑林钠粉针澄清度的影响研究,发现不同厂家生产的丁基胶塞对头孢唑林钠粉针澄清度的影响程度不同;而且药粉与丁基胶塞接触的程度及时间不同,其澄清度不同;直立放置,药粉与丁基胶塞接触的程度小,所受到的影响小;接触的时间越短所受到影响越小[7]。
胶塞硅化主要是为了药物的分装,胶塞硅化与不硅化,其与分装机轨道的摩擦阻力相差50~100倍。硅化过度易造成压塞反弹、跳塞或走机落塞,增加药品污染的风险。硅化也是一种污染,在产品高压灭菌时,硅油会从胶塞中释放出微粒,影响药品的澄清度。有研究证明pH值大于10的药品与药用氯化丁基橡胶塞接触后,可使样品中的不溶性微粒显著增加,为避免此类药品与药用氯化丁基橡胶塞接触后对不溶性微粒的影响,可以考虑使用覆膜药用氯化丁基橡胶塞[8]。
3 小结
注射剂属于高风险产品,影响药品质量的因素很多,由上文讨论可以看到,包材质量的影响绝对不容忽视。如何才能做到注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致呢?
首先,需要对参比制剂包材进行充分的反向解析,了解其可能配方与基本性能特点。选择材质与基本性能不低于参比制剂包材的包装材料作为研究备选材料。其次,对拟研究的产品性质特点需要充分掌握,抓住可能影响产品CQA的包材因素进行科学的试验筛选,通过实验结果确定这些影响因素,从而选定包材型号和生产厂家。这里的核心点是要保证药品质量与参比制剂一致。最后更重要的一点是要保证产品质量能够稳定重现,这不仅取决于包材的选择,也是建立包材质量控制策略的体现。不难看出,未来制药企业对包材的供应商选择、供应商管理、内部质量协议等都将有一些新的升级,保证包材质量的稳定,从而确保药品质量的稳定性。
在注射剂一致性评价研究过程中,包材的选择与研究越来越重要。在注射剂整个生命周期中对包材的质量管理也将成为产品质量控制的重点。
【参考文献】
[1] Vials and Ampouls Merket Intelligence, BEROE.
[2] USP <660>,EP 3.2.1,ASTM E438.
[3] What is the Difference Between Glass Types Commonly Used for Laboratory Glassware. Luke Scicluna,2018.08.20, Camblab.
[4] 郭卫.国内药用中性玻璃管的制造情况分析.
[5] Packaging Challenge for Lyophilized Products,Anupam Chanda,Acta Scientific Pharmaceutical Sciences(ISSN: 2581-5423),Volume 3 Issue 4 April 2019.
[6] 赵霞,胡昌勤,金少鸿.药用胶塞及其应用现状.中国药事2006年20卷7期.
[7] 杨华山.丁基胶塞对头孢唑林钠粉针澄清度的影响.广东药学院学报1997,l 3(4);266.
[8] 郭丙炎,黄宇.不同pH值药品与药用氯化丁基橡胶塞接触后对不溶性微粒影响的研究.
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多