乐普生物:EGFR ADC获得FDA突破疗法认证


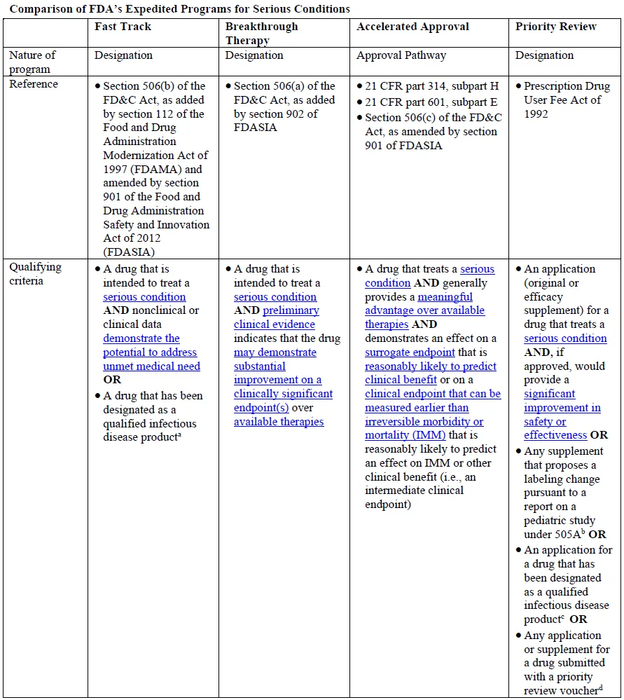
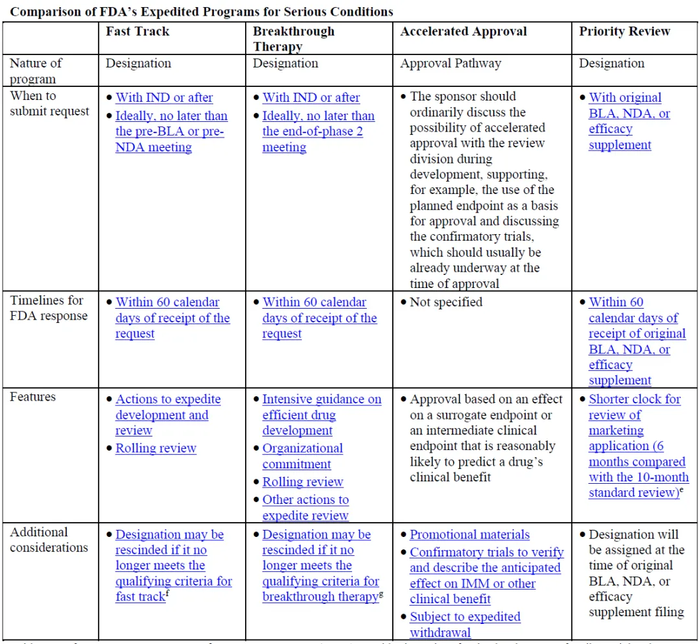
突破疗法为FDA加快新药审评的4种方式之一,资格认定要求非常严格,适用于严重和危及生命的适应症,并在重要临床终点已经表现出相比于现有疗法有重大临床改善的药物。获得突破疗法认证的药物,可以获得所有快速通道的审评待遇,开发过程中可以尽早的获得密集指导等。
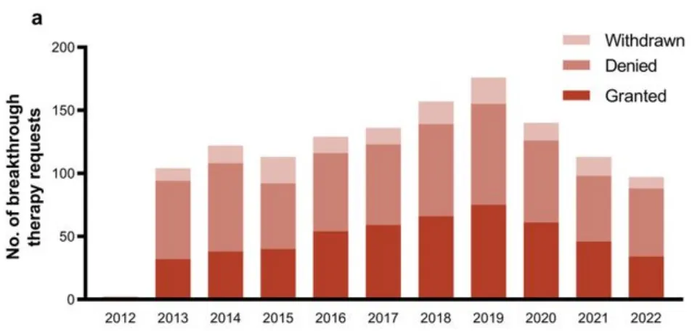
FDA每年授予的突破疗法认证一般不超过50项。今年以来,获得FDA突破疗法认证资格的还有拜耳的BAY 2927088(HER2激活突变NSCLC)、罗氏的PI3K抑制剂Inavolisib(HR+/HER2-乳腺癌)、Vertex的VX-548(糖尿病周围神经痛)、Nuvalent的ALK抑制剂NVL-655和ROS1抑制剂NVL-520、Avidity的AOC 1001(DM1)、迪哲医药的舒沃替尼(EGFR20外显子插入NSCLC)、Kura Oncology的menin抑制剂Ziftomenib(AML)、Vera Therapeutics的TACI-Fc融合蛋白Atacicept(CKD)、DURECT的larsucosterol(NASH)等。
MRG003为乐普生物的核心管线,鼻咽癌、头颈癌均处于关键临床阶段。

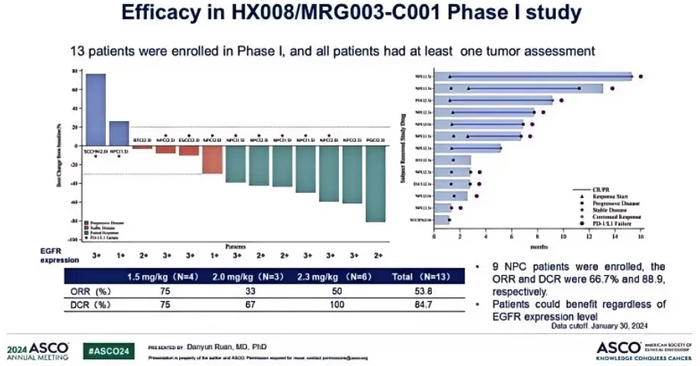
去年ESMO会议上,乐普生物公布了MG003治疗鼻咽癌的IIa期临床最新数据,共计入组61例鼻咽癌患者,30例接受2.0mg/kg MRG003治疗,31例接受2.3mg/kg MRG003治疗。截至2023年3月15日,在先前经PD-(L)1及含铂化疗治疗、可评估疗效的57例鼻咽癌患者中,ORR为47.4%,DCR为79.0%。其中2.0mg/kg剂量组28例可评估疗效,ORR为39.3%,DCR为71.4%,2.3mg/kg剂量组29例可评估疗效,ORR为55.2%,DCR为86.2%。两个剂量组mDoR均为6.8个月。2.0mg/kg剂量组mPFS为7.3个月,2.3mg/kg剂量组PFS数据尚不成熟。严重副作用发生率为11.5%,8例患者因为副作用降低剂量,2例患者因为副作用停止治疗,没有发生治疗相关的死亡案例。
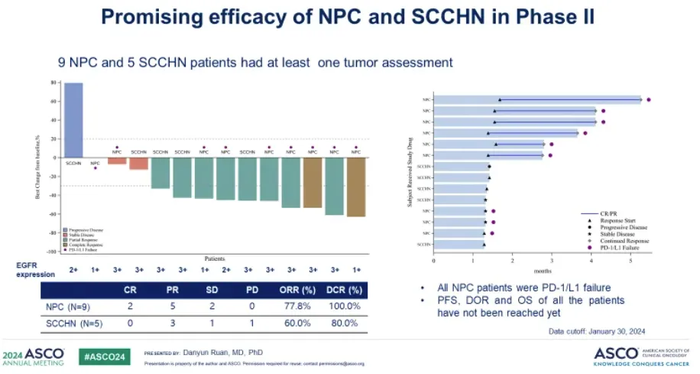
今年ASCO会议上,乐普生物公布了PD-1抗体普特利单抗+MRG003联合治疗的1/2期临床最新数据。截至2024年1月30日,该1/2期临床入组33例患者,一期临床部分包括9例鼻咽癌、1例头颈癌、3例其他实体瘤。二期临床部分包括14例鼻咽癌、6例头颈癌。
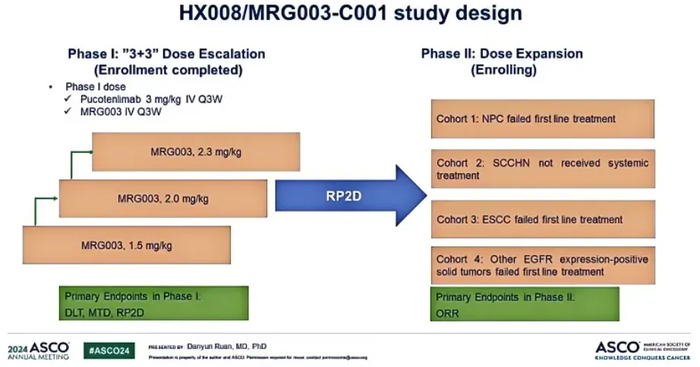
27例可评估疗效的患者,ORR为63.0%(17/27),DCR为88.9%(24/27)。其中二期临床部分,9例经PD-1+化疗一线治疗后进展的EGFR阳性鼻咽癌患者,ORR为77.8%(7/9),DCR为100%(9/9)。5例未经过系统治疗的EGFR阳性头颈癌患者,ORR为60%(3/5),DCR为80%(4/5)。治疗时间最长的患者DoR超过17个月,并仍在继续治疗。
很长时间内,鼻咽癌的标准治疗以化疗、免疫治疗为主,ORR一般在20-30%之间。近年来,鼻咽癌临床一线标准治疗已升级为IO+化疗的模式。不过,这些患者进展后只能选择单药化疗,且无进展生存期短,存在未满足的临床需求。
总结
MRG003由乐普生物自主研发,引领EGFR靶点走向ADC新时代。MRG003治疗鼻咽癌适应症先后获得FDA的孤儿药资格认定、快速通道资格认定、突破疗法认定。临床开发方面,MRG003于2022年9月获得CDE授予治疗鼻咽癌的突破疗法认证,去年10月获得FDA的IND申请,治疗鼻咽癌的注册性2b期临床于去年12月完成所有患者入组,预计今年下半年递交上市申请,有望成为全球首款EGFR ADC新药。此次获得突破疗法认证,意味着MRG003治疗鼻咽癌的突破性疗效获得FDA认可,海外临床开发有望进一步加速,为乐普生物创新药的国际化打下良好基础。
撰稿人 | 乐普生物
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
制药4.0:工厂制造的未来蓝图
2025-12-19
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多