早在1942~1943年,家兔热原测试法就已经被建立;1956年发现细菌性疾病容易引起鲎血淋巴凝固,1968年发现脂多糖能够导致鲎血淋巴凝固,1971年,正式建立了细菌内毒素(鲎试剂)测试方法,1987年FDA发布了关于LAL测试指南;1995年开启了体外热原测试研究, 2010年,单核细胞激活测试法(MAT)被收录欧洲药典。以下是热原检测的方法的时间图。
家兔热原测试是最早的检测方法,通常来讲,家兔热原检测被视为热原检测的金标准。在1942年推出了这一经典体内测试法,在该实验中兔子首先被放置并固定在狭窄的盒子里,让它们适应环境,然后将测试物质注射到至少三只兔子的上耳静脉中,检测兔子的体温,体温升高证明测试物质中存在热原。家兔热原检测法虽然可以检测所有的热原,但是它存在几个缺点:①动物的饲养条件可能会影响结果,导致结果检测不准确;②由于物种特异性的差异,不同种类兔子对热原敏感程度也不同,这也会导致检测结果存在一定的差异;③某些皮下注射的药物(比如脂质体),某些蛋白质溶液(或血液制品)不太适用家兔热原检测,因为它们会引起过敏反应;④动物试验未经过验证,兔子热原测试不能代表人类;⑤需要使用较多兔子,操作复杂、试验时间长。优点:不仅可以检测细菌内毒素,还可以检测样品中未表征的热原。据文献[8]报道,中药、药包材和其他热原的检测以RPT法为主,分别在各自类别中占比66.7%、100%、78.1%。
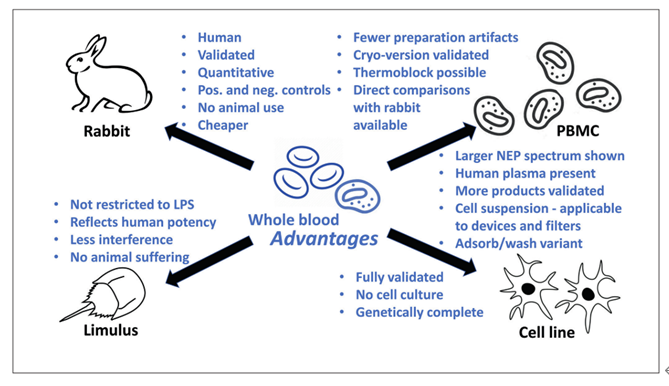
与RPT相比,LAL测试更加灵敏,1956年发现革兰氏阴性菌会导致鲎血(血淋巴)凝固,进而演变成LAL测试。LAL测试法其原理为细菌内毒素分子能够激活鲎试剂中的鲎血细胞溶解物以致发生一系列的凝集酶反应,从而形成人肉眼可见的凝胶状物质;LAL测试法的优点:对革兰氏阴性菌脂多糖灵敏,其灵敏度可以达到0.005EU/ml;然而,该方法也存在缺点:①其他物质(除了药物)也会导致鲎血液凝固,比如二价阳离子盐、螯合物、酸、抗生素和蛋白质等,根据文献报道,抗生素(比如四环素、氨基糖苷、大环内酯、克林霉素等)、白蛋白、β-葡聚糖(该物质激发鲎血凝固原理如下图)均会干扰测试结果;②鲎试剂在采血过程中,会对鲎动物有一定的影响,根据文献报道,对鲎进行采血会导致鲎死亡,其死亡率可以达到10~30%;③仅对革兰氏阴性菌敏感。
由于鲎试剂的紧缺,后来发展了重组因子C测试法,该方法是通过细菌内毒素与重组因子C结合,通过荧光信号来定量产品中的内毒素,该方法的灵敏度可以达到0.005EU/ml,但也仅能鉴别出革兰氏阴性菌的细菌内毒素,与LAL相比,该方法没有使用鲎试剂,可解决鲎试剂缺乏的问题。目前LAL和重组因子C均已列入2020版《中国药典》细菌内毒素检查法应用指导原则中。
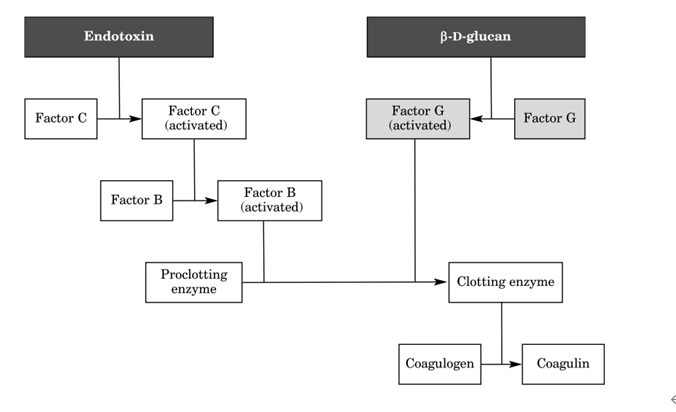
图2 内毒素介导的具有交替葡聚糖激活途径的LAL凝血级联激活[1]
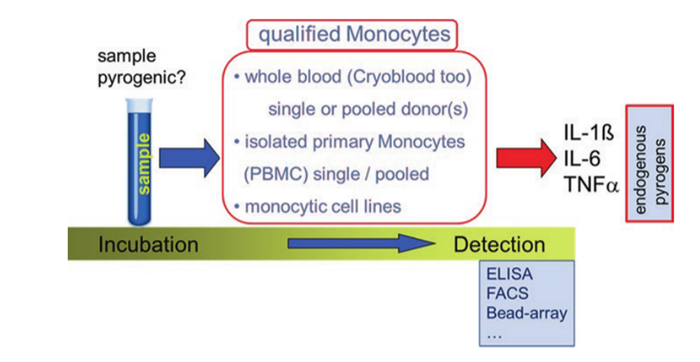
其原理为内毒素接触人全血的免疫细胞(单核细胞)可以释放细胞因子蛋白,如白细胞介素-1-β(IL-1-β),从而引发机体发热,据此建立酶联免疫吸附试验(ELISA)测定全血样品中IL-1-β与内毒素的含量。简言之,即将人血直接暴露于试验材料表面,通过量化促炎细胞因子进行热原的测定。该方法的优点:①不需要使用动物,没有物种差异;②可以利用家兔热原无法测试的产品;③MAT法常用于测定较难处理的基质样品,与RPT法具有较高的相关性,其检出限低于0.1 EU/mL;缺点:成本更高,时间要求更高,接受程度更低,虽然已进入欧洲药典,但中国药典未被纳入;近10 年来研究人员对细胞法又做了许多的改进与探索工作,按细胞的来源不同可将单核细胞法分为3大类,包括全血法、单核细胞系法与人外周血单个核细胞( human peripheral blood monocytic cells,PBMC),Nair等[2]将全血中分离得到的淋巴细胞进行冻存,以IL-1β 为检测指标,对该方法用于检测热原(包括LPS和LTA)的可行性进行研究,结果表明该方法可用于替代热原检测的动物实验方法。贺庆[9]等研究发现PBMC-IL-6 法可检测多种热原,如革兰阴性菌来源的LPS、革兰阳性菌来源的LTA和真菌来源的酵母多糖等,其对上述热原的反应总体较家兔法灵敏。对该方法的验证结果为:实验室内重复性为92%,实验室间重现性为86%,方法灵敏度(即真阳性率)为 90.1% ,特异度( 即真阴性率)为92.3%,与国际同类方法相当。结果表明,PBMC-IL-6法具有对热原的检测谱宽、灵敏度高、应用范围广、可靠性强等特点。作为现有热原检测方法的补充,该方法应得到进一步应用。
2024年中国食品药品检定研究院Qing He[5]发表了一篇关于转基因细胞系的热原检测新方法,该方法是利用NF-κB(一种介导炎症反应的中枢信号分子)作为致热原标记物,通过使用转染了受NF-κB调控的荧光素酶报告基因的单核细胞系THP-1作为体外模型,通过测量荧光信号强度来检测热原;通过研究表明,该方法可以定量和灵敏地检测内毒素(来自不同菌株的脂多糖)和非内毒素热原,在39代细胞中,NF-κB活性和细胞表型稳定性良好,可用于生物制品中热原的检测。通过该方法检测巴利昔单抗、脑炎疫苗等,结果显示,三个独立实验室的实验室内重复性分别为85%、80%和80%,实验室间重复性分别为83.3%、95.6%和86.7%,试验的敏感性(真阳性率)和特异性(真阴性率)可以达到为89.9%和90.9%。
在GMP体系中,通常认为,热原就是细菌内毒素,目前常用的去除内毒素的方法主要包括超滤法、活性炭吸附法、化学降解法、相分离法、阴离子交换色谱法、亲和色谱法、膜吸附法、离子放电色谱法等。其中活性炭吸附法国家不建议采用,化学降解法通常是采用高浓度酸高浓度碱进行破坏,该种手段较为激烈,破坏内毒素的同时,很有可能会将活性药物破坏。下面汇总分析各种去除细菌内毒素的方法及优缺点。
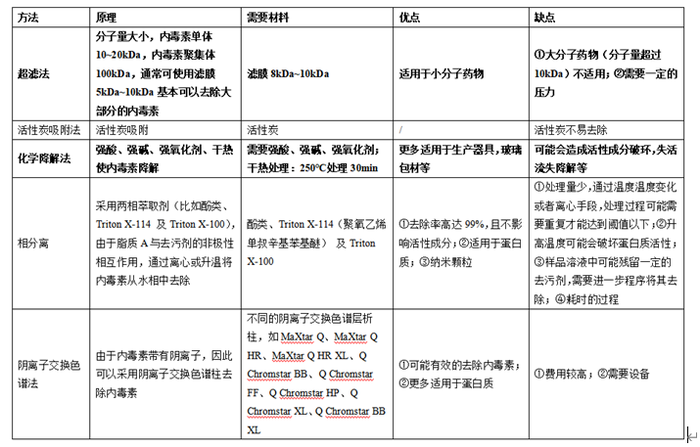
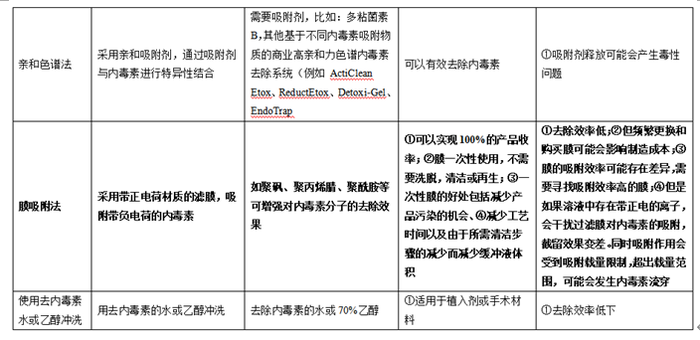
根据上述表格我们可以知道,细菌内毒素每种方法都有不同程度的优缺点,对于不同化合物需要根据情况进行筛选。
对于化学药物注射剂生产来说,去除内毒素的方法更多的是通过原辅包控制以及生产过程控制,其中比较可行简单的方法如超滤法、膜吸附法、酸碱处理以及干热灭菌法;
干热主要适用于玻璃包材、生产管道、生产设备等;通常情况,玻璃类内包材除热原主要分为两个步骤,第一步是对生产设备或包材进行清洗并用注射用水进行淋喷;第二个步是采用250℃干热处理至少30min;而对于胶塞类、软管、密封圈等,主要是通过注射用水冲洗或者漂洗,然后在进行121℃灭菌处理。
超滤法比较适用于小分子化学药物,特别是分子量与内毒素分子量差别较大的化学药,在制剂生产过程中可以在原辅料生产工序或原辅料配制工序中添加,也可以在制剂端加入。de Mas, Kientzler, &Kleindiens等[6]人利用超滤将小分子药物BMS-753493(分子量1.57kDa)与细菌内毒素进行分离,通过使用3 kDa和10 kDa 两种膜尺寸去除BMS-753493 中的内毒素,结果显示,两种膜尺寸均可有效将内毒素浓度降低至<0.03 EU/ml,但与3 kDa相比,10 kDa膜的药物产量较高,约为95%,而3 kDa膜的损失约为55% BMS -753493。该超滤方法最适合从水、盐和对内毒素没有亲和力的小分子药物。目前市面上更多的是采用切向流超滤,超滤法也是唯一通过美国FDA认证的除热原方法。
对于大分子药物,比如蛋白类,纳米颗粒等分子量较大药物,超滤法可能不大适用,也许亲和色谱法、相分离法、阴离子交换色谱法、膜吸附法更加可行。在以前,膜吸附法并未被广泛使用,主要是因为膜吸附法的去除内毒素效率较弱;最近,研究发现,在过滤膜上结合吸附剂,能够大大提高内毒素的去除效率,根据文献[7]研究报道,将两亲性炭质颗粒嵌入PVDF滤膜上,成功去除牛血清白蛋白溶液,结果显示,细菌内毒素去除效率能够大于99.8%,蛋白质回收率大于90%。
从热原检测手段来看,目前主要是采用家兔热原检测和细菌内毒素(鲎试剂)LAL方法,这两种方法相对来说比较传统。与家兔热原检测法相比,MAT法更加方便,体外即可检测,值得被广泛的推广,也许未来会取代家兔热原检测法。与细菌内毒素LAL法相比,重组因子C现已进入中国药典指导原则,虽然暂未列入法定标准,但随着时代的发展,鲎试剂的紧缺,重组因子C很有可能会替代LAL法。至于热原检测的新方法-转基因细胞,目前尚处于实验阶段,还需更多实验加以验证。
从去除热原方法看,我们需要根据具体情况而定,对于小分子药物,更多采用原辅料控制,生产过程控制,对于实在无法购买符合热原要求的原辅料,也许超滤法是目前相对成熟以及接受程度较高的方法。
对于大分子药物,比如蛋白类药物,采取过程控制的同时,可以根据具体工艺选择合适的方式进行热原去除,随着未来的发展,膜吸附法可能是一个比较有前景的方法,因为它具有方便、简单等优点,但该方法还在发展中,相信不久将来,膜吸附法能够被广泛使用。
由于个人认知水平有限,错误难以避免,欢迎留言指正。
参考文献:
[1]Fennrich S, Hennig U, Toliashvili L, 等. More than 70 Years of Pyrogen Detection: Current State and Future Perspectives[J]. Alternatives to Laboratory Animals, 2016, 44(3): 239–253.
[2]Nair S R, Geetha C S, Mohanan P V. Analysis of IL-1 β Release from Cryopreserved Pooled Lymphocytes in Response to Lipopolysaccharide and Lipoteichoic Acid[J]. BioMed Research International, 2013, 2013: 1–10.
[3]Endotoxin Detection and Control in Pharma, Limulus, and Mammalian Systems[M]. K.L. Williams. Cham: Springer International Publishing, 2019.
[4]Hartung T. Pyrogen testing revisited on occasion of the 25th anniversary of the whole blood monocyte activation test[J]. ALTEX, 2021: 3–19.
[5]He Q, Yu C-F, Wu G, 等. A novel alternative for pyrogen detection based on a transgenic cell line[J]. Signal Transduction and Targeted Therapy, 2024, 9(1): 33.
[6]De Mas N, Kientzler D C, Kleindienst D. Endotoxin Removal from a Small-Molecule Aqueous Drug Substance Using Ultrafiltration: A Case Study[J]. Organic Process Research & Development, 2015, 19(9): 1293–1298.
[7]Wu Q, Xu Y, Yang K, 等. Fabrication of membrane absorbers based on amphiphilic carbonaceous derivatives for selective endotoxin clearance[J]. J. Mater. Chem. B, 2017, 5(41): 8219–8227.
[8]林丽花热原检测结果浅析[J] 海峡药学 2020 年第32 卷第8 期
[9] 贺庆,高华,谭德讲等.人外周血单个核细胞热原检测法的研究[J].药物分析杂志,2012,32( 10) : 5-11
撰稿人 | 智药人生
责任编辑 | 邵丽竹
审核人 | 何发



















评论
加载更多