2023年具有里程碑意义的临床研究TOP10
里程碑意义:mRNA疫苗走向更广阔的常见病领域
1月17日,Moderna宣布其RSV疫苗mRNA-1345在老年患者中的III期ConquerRSV研究达主要疗效终点。
呼吸道合胞病毒(RSV)是一种常见的、通过空气传播的RNA病毒。它通常通过口鼻吸入进入气管和肺部,侵入上皮细胞导致细胞死亡,分泌呼吸道粘液阻塞管腔,引起呼吸困难。RSV的易感人群是儿童、老年人及免疫功能受损的成年人。
mRNA-1345是一种针对编码融合前F蛋白的RSV疫苗,与融合后状态相比,它会引发更出色的中和抗体反应。mRNA-1345使用与Moderna的COVID-19疫苗相同的脂质纳米颗粒(LNP),并包含优化的蛋白质和密码子序列。
结果显示,mRNA-1345预防两种及以上症状的RSV相关下呼吸道疾病的效力达到83.7%。基于这些结果,Moderna已在多个国家递交mRNA-1345的上市申请,预计于2024年获批上市。
mRNA-1345的成功意味着在新冠之外,mRNA疫苗也终于在更广阔的常见病领域走通了成药之路,并且攻克的是60多年的研发黑洞RSV预防领域,其开发速度也并未落后重组蛋白疫苗太多。
Moderna早已瞄准不同的疾病领域布局了mRNA疫苗,无惧与传统疫苗同台竞技。流感领域,mRNA-1010新制剂已出线,其III期P303研究已达到所有主要终点。肿瘤领域,个体化新抗原疗法即肿瘤mRNA疫苗mRNA-4157已进入III期临床阶段。

里程碑意义:有望填补肝癌辅助治疗领域空白
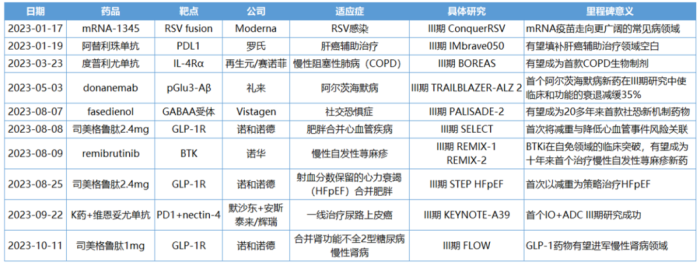
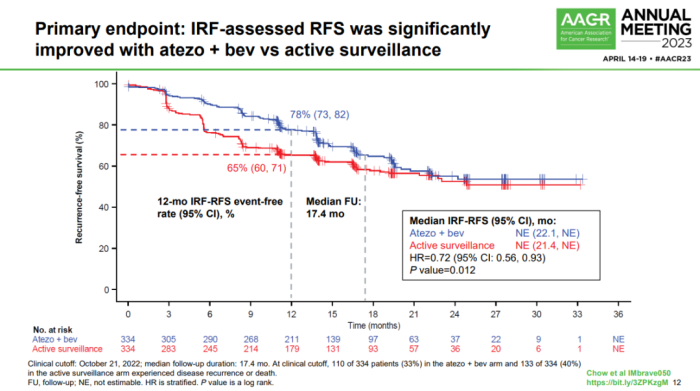
1月19日,罗氏宣布,阿替利珠单抗联合贝伐珠单抗针对早期肝细胞癌(HCC)辅助治疗的关键III期IMbrave050研究期中分析取得积极结果,达到无复发生存期(RFS)的主要终点。
IMbrave050是一项全球多中心、开放标签、随机的III期研究,旨在评估阿替利珠单抗联合贝伐珠单抗作为辅助治疗相比主动监测在进行根治性手术切除或消融术后有高复发风险的HCC患者中的疗效和安全性。
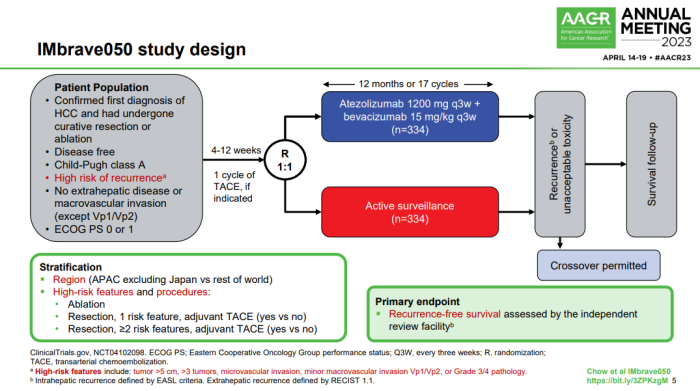
该研究纳入668例患者,他们按1:1随机分为两组,分别接受阿替利珠单抗(每3周1200mg)+贝伐珠单抗(每3周15mg/kg)治疗(治疗时间最长12个月),或只进行主动监测。数据显示,阿替利珠单抗联合贝伐珠单抗可降低患者疾病复发风险28%。
HCC是常见高发癌种,全球每年新发肝癌超过90万例。如果患者在早期确诊,可以对原发肿瘤进行手术切除,不过约70-80%的早期HCC患者会在术后复发,面临更差的预后和更短的生存期[2]。
IMbrave050是有史以来第一个在HCC辅助治疗领域取得成功的III期临床研究,有望变革早期肝癌术后治疗的临床策略、格局和结局,助力肝癌全程管理。值得一提的是,IMbrave050的成功离不开中国力量的贡献,其主要牵头人为中国研究者,中国患者在该项研究中占比近50%。
里程碑意义:有望成为首款COPD生物制剂
3月23日,再生元/赛诺菲联合宣布,度普利尤单抗治疗慢性阻塞性肺病(COPD)的关键III期BOREAS研究成功。这标志着度普利尤单抗成为了首个证明对COPD患者有显著临床获益的生物制剂。
COPD是一种非常常见的慢性气道疾病,目前尚无治愈办法,仅可通过药物治疗以缓解症状。对于病情不太严重的COPD患者来说,仅使用一种支气管舒张剂(β2受体激动剂、抗胆碱能药物、茶碱类药物)即可达到治疗目的;但是病情严重的患者通常需要联用两种以上的药物才可以改善症状。
BOREAS是一项随机、双盲、安慰剂对照的III期研究,旨在评估度普利尤单抗在伴发气道疾病2型炎症的中重度COPD患者中的疗效、安全性和耐受性。该研究共纳入939例40-80岁患者,他们每两周随机接受度普利尤单抗或安慰剂治疗,同时联用吸入皮质类固醇(ICS)、长效β受体激动剂(LABA)和长效毒蕈碱拮抗剂(LAMA)三联治疗。
BOREAS研究的主要终点为52周内中重度COPD的急性发作率。关键次要终点包括12周和52周时肺功能的基线变化(通过支气管扩张剂前FEV1评估)、第52周时圣乔治呼吸问卷(SGRQ)总分变化、第52周时SGRQ改善≥4分的患者比例以及第52周时ERS: COPD量表症状评分的变化。
数据显示,BOREAS研究达到了主要终点,即52周内中重度COPD的急性发作减少了30% (p=0.0005)。与此同时,第12周时Dupixent治疗组患者FEV1较基线提高160mL,而安慰剂组对应数值为77mL (p<0.0001)。此外,BOREAS研究治疗达到了所有次要终点。
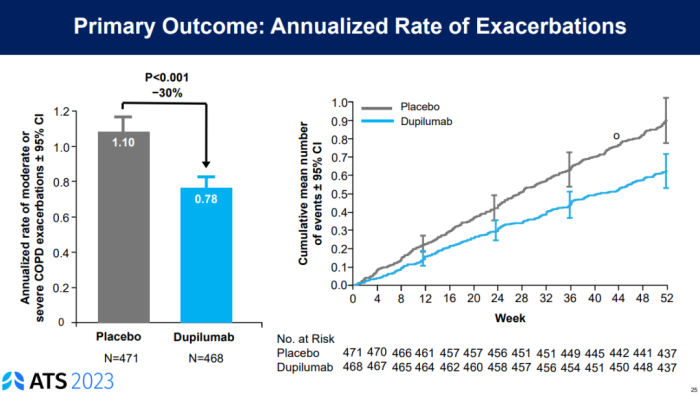
11月27日,度普利尤单抗治疗COPD的第2项III期NOTUS研究传来捷报,达到了主要及关键次要终点。基于两项研究,再生元与赛诺菲计划于2023年底递交该适应症的上市申请。度普利尤单抗或将成为首个获批COPD的生物制剂,进一步释放市场潜力。
里程碑意义:首个阿尔茨海默病新药在III期研究中使临床和功能的衰退减缓35%
5月3日,礼来宣布donanemab治疗早期症状性阿尔茨海默病(AD)患者的III期TRAILBLAZER-ALZ 2研究达到了主要终点,以及所有评估认知和功能下降的次要终点。对比安慰剂,donanemab治疗后减缓了患者临床下降达35%,同时日常生活能力下降的速度减缓了40%。这是首个AD新药在III期研究能达到如此令人瞩目的结果——可使临床和功能的衰退减缓35%。
该消息公布后,礼来股价当即大涨6%,市值突破4000亿美元,超越诺和诺德成为纯药企市值第一名。事实上,donanemab和系列GLP-1新药也是目前支撑礼来超5000亿美元市值的核心。
Donanemab是一款与β淀粉样蛋白亚型N3pG结合的单克隆抗体。它能够与阿尔茨海默病患者大脑中沉积中的β淀粉样蛋白结合,从而促进患者大脑中淀粉样蛋白斑块的清除。基于TRAILBLAZER-ALZ 2研究,donanemab已在全球范围内进入申报上市阶段。
TRAILBLAZER-ALZ 2是一项随机、双盲、安慰剂对照的III期研究,主要分析人群(n=1182)为tau蛋白水平中等且有明显AD临床症状患者。从主要基线的临床和神经病理学特征来看,相比其它试验,该研究入组的患者疾病进展程度更高。
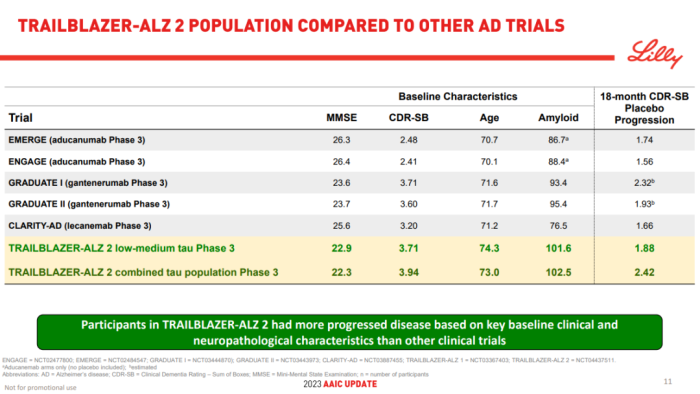
主要终点是AD综合评定量表(iADR,评估患者的认知能力和生活自理能力)评分从基线到18个月的变化,关键次要终点包括基线至18个月的临床痴呆评定量表(CDR-SB,评估患者的认知能力)评分、AD协作研究日常生活能力量表(ADCS iADL)评分、AD认知量表(ADAS-Cog13)评分的变化等。

结果显示,与安慰剂组相比,donanemab组的iADRS评分下降速度减缓了35%;18个月时,donanemab组CDR-SB评分较安慰剂组下降速度减缓了36%;ADCS iADL评分显示,18个月时,donanemab组疾病进展速度延缓了40%。
此外,近一半的donanemab组患者(47%)在1年内没有疾病进展(定义为临床痴呆评分没有下降),而安慰剂组为29%;donanemab将患者疾病进展到下一阶段的风险降低了39%。
安全性方面,总体耐受性良好,但淀粉样蛋白相关成像异常(ARIA)发生率比较高,需要重点关注。Donanemab组有24%受试者出现淀粉样蛋白相关影像学异常-水肿(ARIA-E),有症状ARIA-E发生率为6%;donanemab组有31.4%患者出现脑微出血和浅表铁质沉积(ARIA-H),安慰剂组为13.6%。
里程碑意义:有望成为20多年来首款社恐新机制药物
8月7日,Vistagen宣布fasedienol(PH94B)治疗社交恐惧症的III期PALISADE-2研究达到主要终点。2022年,fasedienol的第一项III期PALISADE-1研究折戟,此次III期临床获得成功意义重大,标志着20多年以来社恐领域首款新机制药物的里程碑进展。
Fasedienol是一种基于pherine设计的作用机制新颖、快速起效的first in class鼻喷雾剂,可调节控制恐惧和焦虑的嗅觉-杏仁体神经回路以及减弱交感自主神经系统的张力。不同于现有的抗抑郁药和苯二氮卓类药物,该药物不直接激活GABA-A受体,也不直接作用于大脑的中枢神经系统。蔼睦医疗拥有该产品在中国、韩国和东南亚地区的开发和商业化权益。
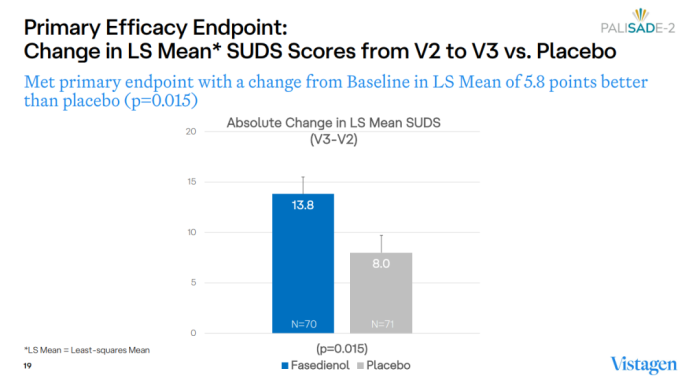
PALISADE-2研究是一项多中心、随机、双盲、安慰剂对照的III期临床试验,共纳入141例成人患者,旨在评估PH94B治疗社交恐惧症的有效性和安全性。研究的主要终点为主观焦虑量表(Subjective units of distress,SUDS)评分的变化。
结果显示,fasedienol组患者的SUDS评分变化相比安慰剂组显著改善(-13.8分 vs. -8.0分)。此外,fasedienol组的应答率也显著高于安慰剂组(40.6% vs. 18.6%),应答率通过临床整体印象-改善(CGI-I)量表评估,定义为焦虑程度大大降低或焦虑程度低得多的患者比例。
Vistagen乘胜追击,计划在2024年启动fasedienol的两项III期研究(PALISADE-3和FEARLESS)。这两项研究都可以作为PALISADE-2研究的补充,以完善fasedienol的上市申请材料。
里程碑意义:首次将减重与降低心血管事件风险关联
2023年,司美格鲁肽凭着无可置疑的实力逐渐登上神坛。
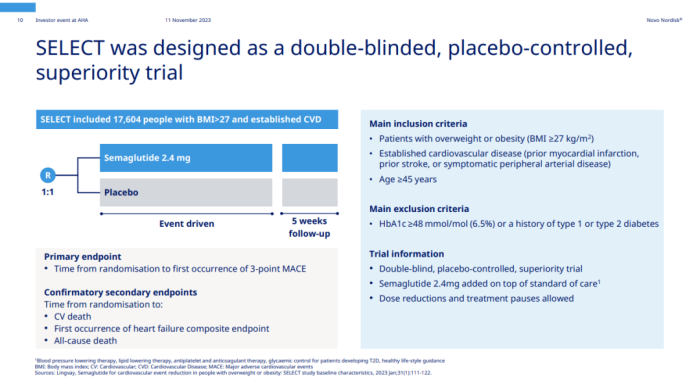
8月8日,司美格鲁肽探索心血管结局的III期SELECT研究终获成功。SELECT研究耗时4年8个月,覆盖41个国家与地区,纳入17604例患者,它是诺和诺德历史上规模最大的一项临床试验。
SELECT研究旨在评估每周1次皮下注射司美格鲁肽(2.4mg)在超重或肥胖合并心血管疾病且不伴糖尿病的患者中预防主要不良心血管事件(MACE)发生风险的效果。
与安慰剂相比,司美格鲁肽能将MACE风险显著降低20%,研究达到主要的复合终点。而且无论患者的年龄、性别、种族和起始BMI如何,司美格鲁肽都能降低其MACE风险。
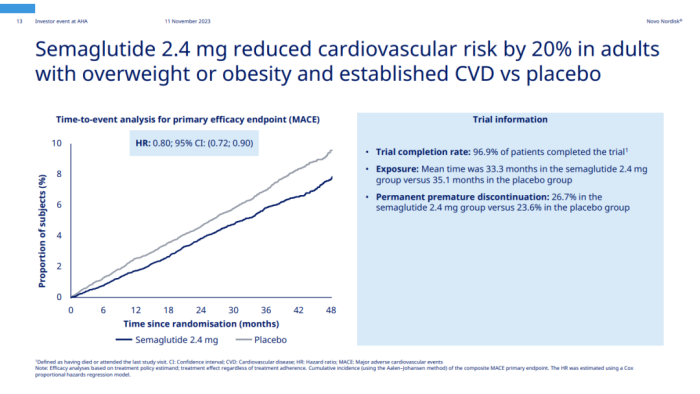
分别对MACE中三个组成部分的分析显示,司美格鲁肽相较于安慰剂使患者的非致命性心肌梗死或心脏病发作的风险降低了28%,心血管死亡风险降低了15%,非致命性中风风险降低了7%。
SELECT研究的里程碑意义在于,首次将减重与降低心血管事件风险相关联。肥胖人群患心血管疾病的风险增加,每年约有200万例心血管疾病死亡归因于肥胖症[1]。但在司美格鲁肽之前,全球还没有哪一种减肥药能证实有效控制体重的同时,还可降低心脏病发作、中风或心血管死亡风险。
里程碑意义:BTKi在自免领域的临床突破,有望成为十年来首个治疗慢性自发性荨麻疹新药
8月9日,诺华宣布其共价不可逆BTK抑制剂remibrutinib用于慢性自发性荨麻疹(CSU)的III期REMIX-1和REMIX-2两项研究均取得积极结果,达到所有主要终点和次要终点,这是BTK抑制剂首次在自免领域取得III期研究成功。这一消息对于其他布局BTK抑制剂用于自免疾病的企业也释放了一个积极信号。
REMIX-1(NCT05030311)和REMIX-2(NCT05032157)是两项设计相同的全球、多中心、随机、双盲、平行组、安慰剂对照III期研究,分别纳入470、455例二代H1抗组胺药无法充分控制病情的成人荨麻疹患者,旨在评估remibrutinib(25mg 每日两次)治疗成人慢性自发性荨麻疹患者的有效性、安全性和耐受性。
两项研究主要终点包括每周荨麻疹活动评分较基线变化以及第12周瘙痒严重程度评分和风团数目评分。结果显示,remibrutinib治疗2周就能快速起效,迅速控制患者症状;治疗12周时患者疾病有临床意义和统计学意义的改善。参加这两项研究的患者将继续接受治疗至第52周,并有机会参与长期扩展试验。
慢性自发性荨麻疹是一种不可预测的全身性皮肤病,其特征是皮肤上自发和反复出现风团或血管性水肿,伴有瘙痒和/或疼痛感,持续至少6周。该疾病影响全球约4000万人次,最常见于20-40岁人群。目前,慢性自发性荨麻疹有效治疗选择有限,约60%患者在接受抗组胺药一线治疗后无法完全控制病情。
诺华表示,如果获得批准,remibrutinib有望成为十年来首个治疗慢性自发性荨麻疹的新型药物,为60%抗组胺药无法控制病情的患者带来简单有效的治疗选择。
里程碑意义:首次以减重为策略治疗HFpEF
8月25日,司美格鲁肽在心血管领域再下一城,治疗心衰的III期STEP HFpEF研究显示出明确的心血管获益。
STEP HFpEF研究纳入了529例射血分数保留的心力衰竭(HFpEF)合并BMI≥30的患者,他们随机接受司美格鲁肽(2.4mg)或安慰剂治疗52周。
研究使用堪萨斯城心肌病问卷临床总结评分(KCCQ-CSS)作为衡量HFpEF症状和身体限制的共同主要终点。在第52周时,司美格鲁肽组患者的问卷得分增加了16.6分,而安慰剂组得分增加了8.7分。
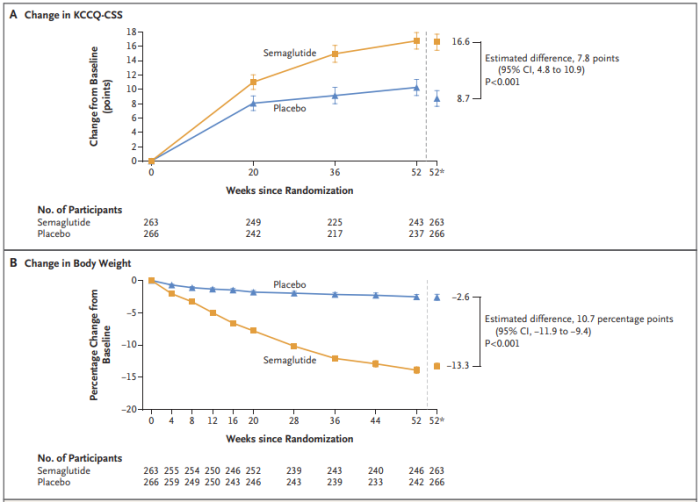
该研究还评估了患者6分钟步行距离测试的变化(次要终点)。司美格鲁肽组步行距离平均增加了21.5米,而安慰剂组仅增加了1.2米。与安慰剂组相比,司美格鲁肽组患者的体重平均减轻了13.3%,C反应蛋白水平降低,表明炎症减轻。
以上种种数据表明,与安慰剂相比,司美格鲁肽能够更大程度地减轻HFpEF合并肥胖患者的心力衰竭相关症状和身体限制,更大程度地改善其运动功能并减轻体重。这不仅将助力司美格鲁肽进一步开拓在心血管领域的治疗版图,也是首次以减重为策略来治疗HFpEF。
里程碑意义:首个IO+ADC III期研究成功
9月22日,默沙东、安斯泰来和Seagen共同宣布了帕博利珠单抗联合nectin-4 ADC维恩妥尤单抗(enfortumab vedotin-ejfv)治疗的III期KEYNOTE-A39研究(也被称为EV-302研究)达到总生存期(OS)和无进展生存期(PFS)的双重主要终点。这是IO+ADC组合疗法取得的首个III期研究成功。
KEYNOTE-A39是一项开放标签、随机、对照III期试验,旨在评估维恩妥尤单抗联合帕博利珠单抗治疗对比化疗对既往未接受过治疗的局部晚期或转移性尿路上皮癌患者的疗效。研究共纳入了886例患者,无论其PD-L1表达。
结果显示,对比化疗组,接受帕博利珠单抗与维恩妥尤单抗联合治疗的患者中位OS为31.5个月,而化疗组为16.1个月;与化疗组相比,联合治疗组的死亡风险降低53%。包括是否顺铂耐受治疗和PD-L1表达水平在内,所有预定义亚组的OS结果一致。
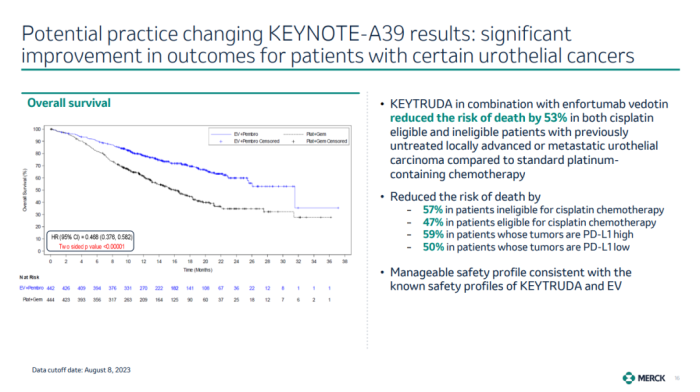
此外,联合治疗组的中位PFS为12.5个月,而化疗组为6.3个月;与化疗组相比,联合治疗组的癌症进展或死亡风险降低55%。
今年4月,FDA基于I/II期KEYNOTE-869/EV-103研究,加速批准了帕博利珠单抗联合维恩妥尤单抗一线治疗局部晚期或转移性尿路上皮癌且顺铂不耐受的成年患者。而KEYNOTE-A39/EV-302研究的成功,使该组合提前5个月获得了FDA的完全批准,代表着转移性尿路上皮癌的潜在治疗范式转变,该组合有望成为尿路上皮癌一线治疗新标准。
里程碑意义:代表GLP-1药物有望进军慢性肾病领域
不止是突围心血管领域,司美格鲁肽在慢性肾病领域的表现也十分惊艳。
10月11日,诺和诺德宣布决定停止肾脏结局试验FLOW。该决定是基于独立数据监测委员会(DMC)的建议,DMC认为中期分析的结果符合提前终止试验预先规定的标准。也就是说,此次是由于司美格鲁肽疗效十分显著而提前终止了研究,此等待遇在新药临床开发中实属少见。
FLOW是一项随机、双盲、平行、安慰剂对照的优效性试验,旨在评估作为标准治疗的辅助疗法,司美格鲁肽(1mg)对比安慰剂在合并肾功能不全2型糖尿病患者和慢性肾病患者中预防肾功能损害进展,以及肾脏和心血管死亡风险的效果。
FLOW研究于2019年启动,在28个国家的400多个研究中心开展,共招募了3534人参与了试验。
根据提前终止试验的决定,诺和诺德将启动终止试验程序。为了保护试验数据的完整性,诺和诺德在试验完成前会对结果保密,预计FLOW研究将在2024年上半年完成。
司美格鲁肽在慢性肾病领域的成功,对诺和诺德的加成无需多言,甚至在肾透析赛道也引发了不小的震荡。诺和诺德发布公告的第2天,透析巨头费森尤斯的股价即下跌近18%。这是因为司美格鲁肽有可能延缓部分慢性肾病患者的疾病进展,从长期来看,或许会影响透析患者的增量。
这3项研究不仅极大地打开了司美格鲁肽的想象空间,也给其他GLP-1类药物树立了新的范式,引领其共同走向更广阔的天地。
创新没有上限,司美格鲁肽还在不断扩展能力边界,多项关键III期研究正在进行中,包括阿尔茨海默病,糖尿病视网膜病变、NASH、外周动脉疾病等大市场适应症。
[1]GBD 2015 Obesity Collaborators et al. N Engl J Med 2017;377:13–27
撰稿人 | 医药魔方
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多