原料药或制剂稳定性研究那些事
Part
1
Part
2
Part
3

Part
4
Part
5
表3 制剂稳定性样品考察批次要求
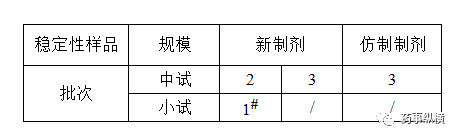

#:中间试验建议的考察时间为12个月,应包括所有的考察项目,检测至少包括初始和末次的4个时间点(如0、6、9、12月);如长期试验的放置条件为30±2°C/65%±5%RH,则无需进行中间条件试验。

#:长期试验是在25°C±2°C/40%RH±5%RH或是在30°C±2°C/35%RH±5%RH条件下进行,由研究者自行决定。
|
|
|
|
|
|
|
|
|
|
|
|

Part
6
Part
7
Part
8
表9 括号法设计示例

表10 某制剂两个规格关于时间点的矩阵设计示例“二分之一简化”
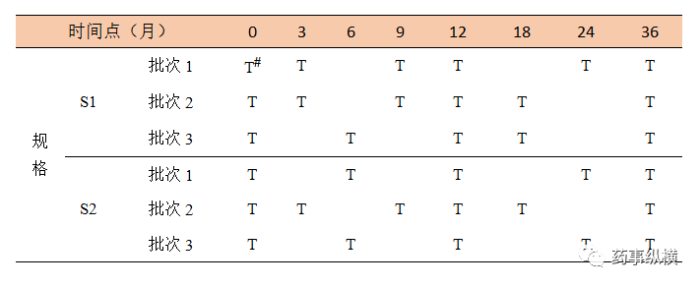
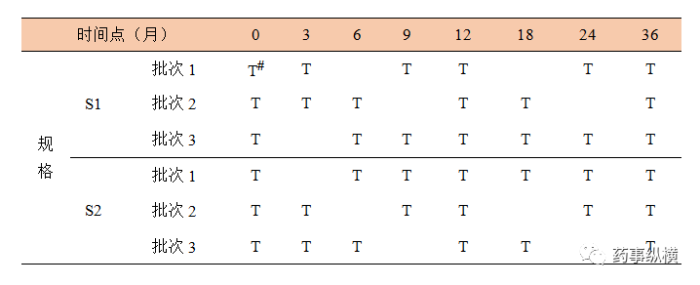
表11 某制剂两个规格关于时间点的矩阵设计示例“三分之一简化”
Part
9
参考文献
[1] CDE,化学药物(原料药和制剂)稳定性研究技术指导原则,2015年第3号
[2] FDA,Guidance for Industry ANDAs: Stability Testing of Drug Substances and Products,June 2013
[3] ICH Q1A(R2): Stability Testing of New Drug Substances and Products,Feb 2003
[4] CDE,化学药品新注册分类申报资料要求,2015年第80号
[5] CDE,化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求,2016年第120号
[6] CDE,霍秀敏,ICH/WHO关于药物稳定性研究指导原则介绍,2003年11月08日
[7] CDE,张明平和霍秀敏,ICH确定新的稳定性试验条件的背景介绍,2004年04月20日
[8] CDE,黄晓龙,稳定性考察中的热循环(冻融)实验简介,2003年08月04日
[9] ICH(Q1B),稳定性试验: 新原料药和制剂的光稳定性试验,1996年11月06日
[10] ICH(Q1E),稳定性数据的评价,2003年02月06日
[11] ICH(Q1D),新原料药和制剂稳定性试验的括号设计法和矩阵设计法,2002年02月07日
[12] CDE,手性药物稳定性研究的几点认识,2005年09月14日
[13] CDE,霍秀敏,简略稳定性研究设计介绍,2005年05月13日
[14] 霍秀敏,魏农农,何伍,等.解读《化学药物(原料药和制剂)稳定性研究技术指导原则》[J].中国临床药理学杂志,2014(10):974-978.
撰稿人 | 药事纵横
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多