冻干产品无菌工艺模拟试验方案改进及实施研究
采用培养基代替药品进行无菌工艺模拟试验,是无菌生产工艺的一种必要方式。为了确保无菌产品的无菌性,文章对冻干产品无菌工艺模拟试验方案的实施进行阐述,介绍了该方案的准备条件,灌装、冻干和轧盖过程,过程取样以及环境监控等,对方案进行部分改进,优化了方案内容,并对无菌工艺模拟试验的结果进行分析,结合实例探讨了西林瓶生产线冻干产品培养基试验的策略,以提高非最终灭菌产品的无菌保障水平。
无菌工艺模拟试验是指采用微生物培养基替代无菌产品,对整个无菌生产工艺进行评估验证的技术,通常也被称为“培养基灌装试验”。需要把培养基灌装于无菌容器中,并在无菌生产环境中进行转运,通过模拟此无菌工艺的过程,最后将灌封有培养基的容器在适当温度下进行培养,检查容器内微生物的生长状况,来对无菌工艺模拟试验的结果进行评价,评价该试验是否在操作过程中产生了污染。通常将此试验应用于非最终灭菌的无菌产品中,而对最终灭菌产品没有强制的要求。
根据《药品生产质量管理规范(2010 年修订)》(Good Manufacturing Practice of Medical Products,GMP)以及附录1的“无菌要求”,无菌产品的生产应当进行培养基灌装试验。在无菌生产过程当中,对于直接接触药物的设备、部件、灌装容器以及原料,虽然已经过灭菌,但是当采用这些要素进行无菌生产时,仍然会由于各种因素导致产品发生污染,从而影响了无菌产品的质量。因此,无菌工艺的评估应当采用一种更合适的方式进行。无菌工艺模拟试验,是对无菌工艺进行评估的一种验证技术,采用培养基模拟完成实际无菌生产操作后,可以对结果进行评价,借以确定实际生产中产品被污染的概率。
广西梧州制药(集团)股份有限公司生产的无菌产品为冻干制剂,故以冻干产品的无菌工艺模拟试验来模拟整个工艺过程,包括从部件、材料的灭菌准备,一直到完成灌装和轧盖等整个过程。
而对于无菌工艺模拟试验方案的设计中,工艺条件的选择应当选取合理的“最差条件”,即整个工艺流程,应采用最差条件来进行试验。最差条件即在工艺规程允许范围内,正常生产会遇到的最差情况,其并不包括由偏差引起的超出工艺要求的特殊情形。如果在最差条件下培养基灌装试验仍然取得好的结果,那么说明在比最差条件还要好的正常实际生产过程中,无菌保证水平会更有保证。
冻干产品的无菌工艺模拟试验最差条件设计,可以包括在准备阶段将物料、灌装器具、设备等按照工艺要求在无菌条件下放置允许的最长时间;灌装时可以在关键区域保留最多的人员;模拟在工艺允许范围内更长的灌装时间;控制无菌工艺模拟试验灌装速度等。
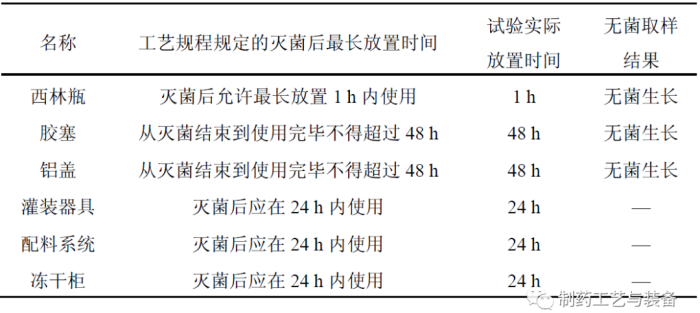
冻干工艺所采用的西林瓶、胶塞、铝盖、灌装器具、配料系统和冻干柜,将其灭菌并放置工艺规程允许的最长时间后使用,如表1所示。
其中,为了考察其放置最长时间后的无菌水平,西林瓶、胶塞和铝盖在放置结束后,均取样进行了无菌性检查,结果均符合无菌工艺要求,可继续用于无菌工艺模拟试验。
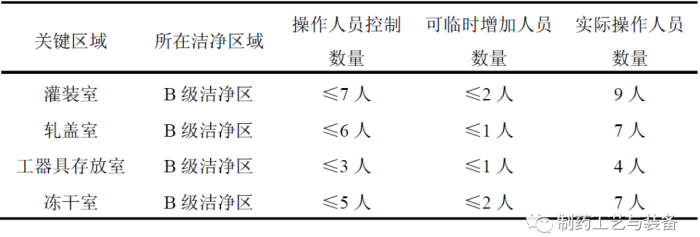
参与无菌工艺模拟试验的关键区域人员,均按表2所示进行人员控制。进行无菌工艺模拟试验时,实际操作人员数量均按工艺规程允许的最大人员数量进行。其中,各洁净室组成人员,可由操作工、维修人员和检测人员组成,操作人员负责无菌模拟试验的生产操作,检测人员负责微生物取样、环境监控等操作,维修人员负责对设备进行模拟维修或突发情况的处理。
表2 培养基灌装试验人员控制记录表
在灌装运行速度上,基于风险评估,应对灌装速度进行评估并说明所定速度的理由。一般来说,对于广口的容器,可采用在无菌生产区暴露较长时间的工艺,即降低灌装速度,考察无菌过程是否受到污染;而对于瓶口较小的容器,可采用高速运行的方式来评估,在高速运行中进行大量手工操作干扰,用于评估无菌生产工艺是否受到污染。
培养基灌装的持续时间控制是方案设计时必须考虑的重要问题,综合考虑生产操作、操作干扰和实际无菌操作的周期后,尽管最准确的方法是模拟全批量的操作时间,因为其最能反映实际生产运行的情况,但也可以有其他合理且适当的模式,预估模拟试验的时间一般不少于正常实际操作生产的时间,以更好地反映整个过程所带来污染的风险。
厂房设施设备以及公用系统的准备具体内容如下[1]。进行冻干产品无菌工艺模拟试验,需要确认工艺设备、公用系统和辅助设施都已经按照预期进行了相应的验证,且物品、厂房和设施所使用的消毒剂和消毒方式也完成了相应的验证。
对于药液及产品所接触到的气体、设备组件、容器、器具灭菌工艺都应完成相应的验证,无菌生产区域的环境,应达到设计要求,能够持续稳定地运行。
参与无菌工艺模拟试验的人员,应接受药品GMP、无菌操作、微生物知识以及实施无菌模拟试验的相关培训,且进入无菌洁净区的全部人员,都应通过无菌更衣程序的确认,确认每位参与者可进入的区域以及其所允许的无菌操作项目。
进行无菌工艺模拟试验,应充分考虑模拟介质与无菌工艺的适宜性,应结合被模拟产品的特点以及模拟介质的可过滤性、澄清度、灭菌方式等方面来选择培养基,尽可能地模拟无菌生产工艺流程,且不应该选择具有抑菌性的模拟介质,以确认模拟试验的可信度。通常可以采用的培养基为胰酪胨大豆肉汤(Tryptic Soytone Broth,TSB),其无抑菌作用,且灭菌方式简单易操作;易溶解和扩散(若溶解性不好,悬浮在培养基中的模拟介质使培养基发生浑浊,容易影响结果的判断);易清洁,对设备没有腐蚀性,对人体无害,不会对环境造成污染。培养基在使用前已进行除菌过滤,其灭菌方式应经过验证。
无菌工艺模拟试验所用到的包装材料,应按相关质量标准检验合格,具备检验合格报告单。
ApexZ50 激光尘埃粒子计数器、MAS-100NT浮游菌采样仪。
TSB 培养基、TSA 培养基、培养皿(55 mm、90 mm)、西林瓶(7 mL)、胶塞、铝盖。
冻干产品的无菌工艺模拟试验模拟的是整个工艺过程,包括培养基准备过程、灌装过程、冻干过程、轧盖过程和培养基微生物的培养过程,应在与实际生产相同条件下尽量模拟实际生产完成的相应操作,还应充分考虑生产时可能造成污染的各种因素,对各种干扰活动进行模拟,模拟无菌灌装期间遇到的最差状况下的操作。
试验所使用的培养基应是经过微生物促生长能力检测合格的培养基,培养基(TSB)配制完成后,经除菌过滤至无菌储罐中,并在无菌储罐中贮存工艺允许的最长时间,贮存结束后,进行下一步的模拟灌装试验。
灌装前,应按正常生产操作进行灌装部件的组装,并进行装量的调节。由于培养基灌装量较大(约9万支),且为瓶口较小的7 mL 西林瓶,故采用高速灌装,并在灌装过程中穿插干扰操作的模式来进行模拟,根据洗烘灌联动线的整体性能,把灌装速度控制在350 支/min,灌装第2 h 和第4 h,分别模拟一次灌装干扰操作,综合考虑生产操作、各种干扰和实际无菌操作的周期后,决定总灌装时长约为6 h。
在无菌工艺模拟试验过程中,必须模拟所有正常操作的活动,包括取样、称重、沉降菌换皿、层流车转运和产品出入冻干柜等,而除了这些计划的活动以外,还存在非计划却不可避免发生的活动,比如西林瓶倒瓶、爆瓶的处理,灌装异常的处理,各种灌装机故障维修等,因此本次无菌工艺模拟试验在进行所有正常操作的活动外,通过改进方案,需进行非正常的突发事件的处理来模拟最差生产状况[2]。表3 可以作为本次无菌模拟试验干扰项目和频次的参考。
灌装完的西林瓶运送至冻干柜内,关闭冻干柜门后,放置10 h 后,模拟抽真空补气操作2 次(每次抽真空至500~600 mbar),引发柜内空气流动,再通过无菌空气达到气流平衡。
冻干结束后,打开柜门摆放至少2 h,西林瓶出柜,放置密闭车至少6 h,然后进行轧盖,轧盖完成后,所有培养基产品全部制备完毕。
已灌装的培养基应当在适当的条件下进行培养,以检出微生物,且培养温度应适宜于一般微生物及环境分离菌的恢复生长。
(1)阴性对照。
在模拟灌装过程中,抽取16支灌装并半加塞的培养基,进行压塞密封,作为阴性对照品,其中8 支于30 ℃~35 ℃条件下培养14 天,另8 支于20 ℃~25 ℃条件下培养14 天,其阴性对照不应出现浑浊。
(2)阳性对照。
为了确认培养基的促菌生长能力,在模拟灌装试验中,抽取25 支灌装后半加塞的培养基,压塞密封,作为阳性对照品,其中5 支接种金黄色葡萄球菌混悬液,5 支接种铜绿假单胞菌混悬液,5 支接种枯草杆菌混悬液,5 支接种白色念珠菌混悬液,5 支接种黑曲霉悬浮液,各菌种混悬液均为0.1 mL,浓度<100 cfu/0.1 mL。接种后,按药典规定进行菌种的培养。培养结束后,观察阳性对照品的生长情况,应被证实有菌生长则为合格。
(3)试验样品的培养及调查。
无菌工艺模拟试验的全部样品应当在适宜的温度条件下培养14 天,先于较低温度(20 ℃~25 ℃)下培养至少7 天,然后在较高温度(30 ℃~35 ℃)下培养至少7 天,在低温和高温的培养过程中和培养结束后,分别观察一次,并记录检查结果,若发现污染应明确记录样品数量,若出现破损应记录并检查破损原因。
由于灌装数量超过10 000 支,若出现1 支污染,需进行调查;出现2 支污染,需调查后进行再验证。培养基灌装的标准允许少量污染瓶的存在,但这绝对不是允许投放市场的
无菌产品中可以存在受污染的状况,无菌工艺的目的就是防止污染,发现任何污染样品均应进行调查,分离到的污染微生物更应鉴别到种。若培养基灌装反复出现污染,即使每次都符合标准,也必须采取更严格的防污染措施[3]。
无菌工艺模拟试验过程中,需对过程中的无菌包材进行取样,并对环境进行监控,以考察生产操作的实际情况,不应采取特别的生产控制和预防措施,制造特别良好的工艺环境,这样会导致不准确的评估结论,造成工艺条件良好的假想,过程取样及环境监控如表4 所示。
本文详细描述了冻干产品无菌工艺模拟试验的改进和实施。因不同的产品剂型,如悬浮液的无菌灌装、无菌粉末产品、无菌霜剂、无菌乳膏剂等,工艺会有一些差异,灌装过程中的干预方式、操作方式等在方案的设计上会有细节的不同,需要技术人员根据不同的剂型进行方案设计,并完整记录整个过程,在培养结果发生异常时,灌装过程的记录会成为基础的调查证据。随着法律法规的不断完善,制药工艺的不断优化和制药工业企业的不断发展,无菌工艺模拟试验方案的设计将会愈加完善。
[1] 侯海涛,钱芳. 冻干粉针剂无菌工艺模拟试验研究[J]. 科学与财富,2015,7(8): 173-174.
[2] 陈华美,黄渝,王大平. 培养基模拟灌装试验方法探讨[J].山东化工,2015,44(8): 88-90.
[3] 国家食品药品监督管理局药品认证管理中心. 药品GMP指南: 无菌药品[M]. 北京: 中国医药科技出版社,2011.
撰稿人 | 周凡婷、邓凯
责任编辑 | 胡静
审核人 | 何发













评论
加载更多