翰森制药2023中报:创新药收入占比超六成 前沿管线稳健迈入收获期
领先的创新实力、加速展现的创新成效背后是"持续加码的研发投入"。2023年上半年,翰森制药研发投入大涨25.8%达到9.29亿元,占收入比例上升至20.6%。凭借不断夯实的研发根基和对外合作,公司高效推进高潜管线的源头创新和突破创新,超过30个创新药正在开展40余项临床,研发势能强劲。
值得关注的是,报告期内,翰森制药创新药产品组合进一步扩容,第7款创新药圣罗莱(培莫沙肽注射液)获批上市。圣罗莱是全球唯一EPO受体高特异性月激动剂,适用于治疗因慢性肾脏病(CKD)引起的贫血,包括未接受红细胞生成刺激剂(ESA)治疗的成人非透析患者,以及正在接受短效促红细胞生成素(EPO)治疗的成人透析患者。"每月一次,安心达标", 圣罗莱显著延长半衰期,只需每月给药一次,大大降低给药频率,填补了我国乃至全球新一代ESA类月制剂的空白,为肾性贫血患者提供了全新治疗选择。
创新药收入占比超六成 医保扩大覆盖惠及民生
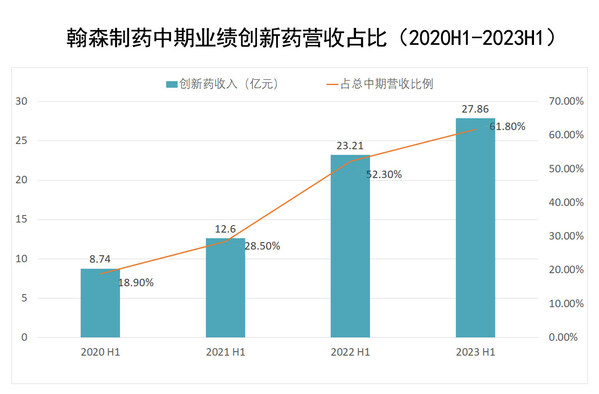
2023年上半年,依托阿美乐、恒沐、豪森昕福、昕越、孚来美、迈灵达等6款纳入国家医保目录的创新药,在差异化、高临床价值的领先优势下,翰森制药商业化的创新药矩阵加速放量,业绩增长强劲,创新药总营收达到约27.86亿元,占收入比例达约61.8%。
公告显示,报告期内,翰森制药在抗肿瘤、抗感染、中枢神经系统、代谢及其它等疾病领域分别录得收入约25.55亿元、6.01亿元、7.01亿元、6.54亿元,占收入比分别约为56.6%、13.3%、15.5%、14.6%。
数据背后是产品力的支撑,可以看到经过多年创新布局,翰森制药在核心优势领域持续深耕并逐步扩大领先优势。
头号创新产品阿美替尼用于晚期非小细胞肺癌的两个适应症进入医保后加速放量,创造了可观收益。阿美替尼是首个中国原研三代EGFR-TKI,作为Ⅰ级或首选推荐,阿美替尼已被包括《CSCO非小细胞肺癌诊疗指南(2023版)》在内的8份国家级诊疗指南收录。阿美替尼专利现已分别荣获中国专利金奖和江苏省专利金奖。
公司罕见病药物昕越(伊奈利珠单抗注射液)2023年1月新增纳入国家医保目录后,加速开拓视神经脊髓炎谱系疾病(NMOSD)市场。昕越现为我国首个且目前唯一的NMOSD医保用药,已被纳入《中国视神经脊髓炎谱系疾病诊断与治疗指南(2021年版)》获得A类推荐。
此外,恒沐(艾米替诺福韦片)、豪森昕福(甲磺酸氟马替尼片)、孚来美(聚乙二醇洛塞那肽注射液)、迈灵达 (吗啉硝唑氯化钠注射液)等创新药均保持了良好增长。
随着翰森制药第7款创新药圣罗莱获批上市,以及与德琪医药就"同类首创"和"同类唯一"的口服选择性核输出蛋白(XPO1)抑制剂希维奥(塞利尼索)达成在中国大陆的商业化独家合作,在实体肿瘤、血液肿瘤、抗感染、中枢神经系统疾病、代谢等优势治疗领域,翰森制药进一步丰富了广泛且高度差异化的创新产品组合,这些创新产品多为"国产首个""同类首个",先发优势明显,未来销售峰值可观。
翰森制药执行董事吕爱锋表示:"翰森制药在2023年上半年取得了优秀的业绩表现,为公司全球化可持续创新发展夯实了基础,未来3年将是翰森制药创新药密集收获期,规划每年有8-10个IND申请,2-3个NDA申请;预期至2025年将上市超过15款创新药,创新药收入占比将超过80%。"
自研+BD双擎驱动 加速推进前沿靶点和差异化创新
作为健康领域的深耕者,翰森制药始终锚定临床深层次需求,持之以恒地通过自主研发、BD合作、技术平台合作积极探索新靶点、拓展新方向,形成了丰富的具有竞争力的研发管线,厚植长期可持续增长动能。
公司现已构建起全球创新研发生态体系,共有研发人员1600余名,快速推进多款在研产品进入关键临床或审批阶段,并取得多项专利成果。2023年上半年,翰森制药共获得中国授权专利28项(含港澳台授权8项),国外授权专利13项;1款创新药艾瑞芬净片(Ibrexafungerp)上市申请获受理;新增六个进入临床阶段的创新药,获得临床批件十一项,有四个新产品获批上市。
报告期内,翰森制药多项创新药的临床研究进入概念验证(POC)阶段,包括HS-10353胶囊拟用于治疗抑郁症、HS-10365胶囊拟用于治疗甲状腺癌、HS-10380片拟用于治疗精神分裂症、HS-20094注射液拟用于2型糖尿病、HS-20093注射剂拟用于治疗复发或难治性骨与软组织肉瘤,以及HS-10374片拟用于治疗银屑病各相关临床试验。
此外,翰森制药已上市创新药的多项研究也在稳步推进。为拓展阿美替尼在肺癌细分领域的治疗潜力,为更多NSCLC患者提供从早期到晚期,从辅助治疗、一线治疗、二线及后线治疗和联合治疗等全方位多维度的用药方案,针对阿美替尼已开展多项注册临床研究,包括阿美替尼联合含铂双药化疗一线治疗EGFR敏感突变NSCLC、术后辅助治疗NSCLC等适应症,目前两个注册研究均已完成受试者入组。
在罕见病领域,翰森制药引入的伊奈利珠单抗用于重症肌无力和IgG4相关疾病两个适应症在国内已推进至Ⅲ期临床,伊奈利珠单抗曾被美国FDA及欧洲药品管理局(EMA)授予孤儿药资格,并被FDA授予突破性疗法资格认定(BTD),除中国外,已先后在美国、日本和欧洲上市。
在厚植差异化创新势能的同时,翰森制药研究成果频频得到国际医学界认可。报告期内,翰森制药B7-H3 ADC(HS-20093)、c-METTKI(HS-10241)在研项目分别入选2023年美国临床肿瘤协会(ASCO)年会壁报讨论、摘要汇编及壁报,瘤种涵盖实体瘤和血液瘤管线。其中HS-10241还凭借着优异的I期临床数据在《胸部肿瘤学杂志(JTO)》子刊发表;1类创新药RET抑制剂(HS-10365)I期临床数据在2023年美国癌症研究学会(AACR)年会发布;阿美替尼5篇研究成果亮相2023年欧洲肺癌大会(ELCC),在所有EGFR-TKI中名列第一,占总篇数的45%;聚乙二醇洛塞那肽最新临床研究论文在国际知名药理学期刊Front. Pharmacol.发布,显示了卓越的降糖疗效和良好的安全性。
翰森制药CMO吴穷博士表示:"翰森制药以‘持续创新,提高人类生命质量'为使命,聚焦创新药、生物药进行前瞻性布局。我们勤耕不辍、不断精进研发策略、提高研发效率,丰富更有效、更具差异化的全球高潜产品管线。"
始终坚持负责任创新 积极践行可持续发展
报告期内,凭借出色的ESG管治绩效,翰森制药入选标普全球(S&PGlobal)首次发布的《可持续发展年鉴(中国版)》,以大幅领先的ESG评分位列行业最佳1%,并获得"行业最佳进步企业"殊荣。根据年鉴评选规则,这两项成绩标志着翰森制药2022年CSA评分(63分)居于中国制药行业榜首,且为行业提升幅度最大的公司。此前翰森制药已成功入选标普《可持续发展年鉴》(全球版),成为中国大陆制药行业唯一入选公司。
作为中国领先的创新驱动型制药企业,翰森制药不断强化治理、诚信合规,提升经营效率;坚持创新驱动、质量至上,促进健康公平可及,始终致力于成为全球医药创新的开拓者、健康产业的深耕者、绿色力量的行动者,积极推动公司为中国乃至全球患者提供更多创新性治疗选择。
撰稿人 | 翰森制药
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多