美国FDA药品监管法规数据库建设对我国的启示
张静、关月月、揣红梅、唐桃群、潘威、杨悦
2023-08-31
本文通过对美国FDA药品监管法规文件数据库进行研究,从数据库的结构、资源和功能等方面得出启示,以期对我国药品监管法规文件数据库的进一步完善提供参考。
目的:研究美国食品药品监督管理局(FDA)药品监管法规文件数据库的构建,为完善我国药品监管法规文件数据库提供参考。
方法:详细介绍FDA药品监管法规文件数据库的构成及功能,为我国数据库的进一步完善提出建议。
结果与结论:FDA网站建立了相对完善的药品监管法规文件数据库,其结构的逻辑性、资源的完整性及检索功能的便捷性均存在可借鉴之处。我国正在探索建设、完善药品法规数据库,其系统性与科学性需要不断提高,从而更好地满足公众及行业需求。
随着我国药品监管体系的发展日趋完善,相关法律法规文件的数量也在与日俱增[1-3]。公众和行业访问需求不断增加,对访问的便利性、时效性提出了更高要求。我国药监部门一直致力于监管信息化、现代化,并依托各监管机构网站逐步建立和完善了我国药品法规数据库,历经多次改版升级,已初具成效。但从结构、资源和功能方面来看,我国药品监管法规文件数据库在系统性和专业性方面还难以满足公众和行业不断增长的需要。国际上,一些发达国家在药品监管法规文件数据库建设方面的先进经验可供我国学习和借鉴,其中美国的情况最有代表性[4]。美国食品药品监督管理局(Food and Drug Administration,FDA)历经百年发展,形成了法律、法规和指南的完整药品监管体系[5],FDA网站涵盖了相对完善的药品监管法规文件数据库,对我国药品监管法规文件数据库的提高有借鉴意义。本文通过对美国FDA药品监管法规文件数据库进行研究,从数据库的结构、资源和功能等方面得出启示,以期对我国药品监管法规文件数据库的进一步完善提供参考。
美国是最早建立法规文件数据库的国家,具有多个科学、权威、完整的法律法规文件数据库[ 6 ]。法规文件数据库的建立需要依托成熟的法律法规体系,美国药品监管法规体系包括法律(Law)、法规(Regulation)和指南文件(Guidance Document)3个层级[7]。FDA网站的数据库不仅涵盖了所有与药品有关的法律法规原文,还将所有技术指南文件纳入其中,供公众免费查询。FDA官方网站自上线运营以来,几经改版,不断更新法律法规数据库,其结构、资源与功能等日趋完善,为药品监管者、行业及患者提供更加便捷、准确的医药信息服务。
在美国,法律是由国会颁布的,所有一般性、永久性法律均汇编于《美国法典》(United States Code,USC)中。第一部《美国法典》于1926年正式发布,与食品和药品相关的法律条文主要收录于第21卷[8]。其中,《美国法典》在药品领域最为重要的是FD&CA,被收录于第21卷第9章(21USC.ch.9)。现行的《美国法典》分为54卷,卷下设章、部分、节(常用§表示)、段、款和项几个层级。
FDA网站的“监管信息”专栏,将法律数据库分为“FD&CA”“其他影响FDA的法律”和“FD&CA修正案”3个板块[9]。其中,FD&CA板块设置了《美国法典》数据库[10]的外部链接,并提供了可直接跳转至“第21卷—食品与药品”(Title 21—Food and Drug)的选项。《美国法典》数据库具备多种检索功能,包括关键词检索、特定字段检索、法律编号检索等,并可以分章、分节下载XML、XHTML、PCC和PDF多种格式的法律原文。为便于公众在《美国法典》数据库中检索法律条款,FDA法律数据库根据FD&CA章节划分,将FD&CA和《美国法典》的条款编号相对应。而在“其他影响FDA的法律”和“FD&CA修正案”板块,不仅列出相关法案的发布时间和公法号,还附上国会网站[11]的外部链接,供公众查询法案原文。此外,对于一些重要的修正案(例如《21世纪治愈法案》《FDA再授权法案》等),还列出法案简介及法案要点等信息。
1938年,美国联邦政府参照《美国法典》的编纂方式开始进行联邦行政法规的编纂,并发布第一版《美国联邦法规》(Code of Federal Regulations,CFR)[12]。在结构上,《美国联邦法规》与《美国法典》非常相似,将与食品和药品相关的法律条文收录于第21卷。
FDA遵循CFR的原有结构,在其网站上将CFR第21卷单独建立药品法规数据库[13]。FDA法规数据库具备3种检索功能:1)根据法规编码进行明确检索;2)根据目录导航选择检索章节;3)通过输入关键词或关键字段进行全文检索。其中,后2种检索方式可以结合使用。FDA法规数据库还具备输出和分享功能,用户可将检索到的法规原文发送到邮箱,或直接分享到Facebook、Twitter等平台。此外,FDA在法规专栏还附上了电子联邦法规(e-CFR)的链接,可一键跳转至CFR的官方电子数据库。与FDA法规数据库不同的是,e-CFR还可使用布尔逻辑检索和近似搜索。FDA法规数据库每年更新1次,而e-CFR每日更新1次,更具时效性。
根据《良好指南制定规范》(Good Guidance Practice)(21CFR§10.115)中定义,“指南”是指为FDA员工、注册申请人/发起人和公众准备的,用来描述FDA就某个法规议题所做出解释或指导的文件[14]。FDA每年发布大量的指南文件,大部分适用于业界,还有一些用于规范FDA内部员工的工作程序及标准。
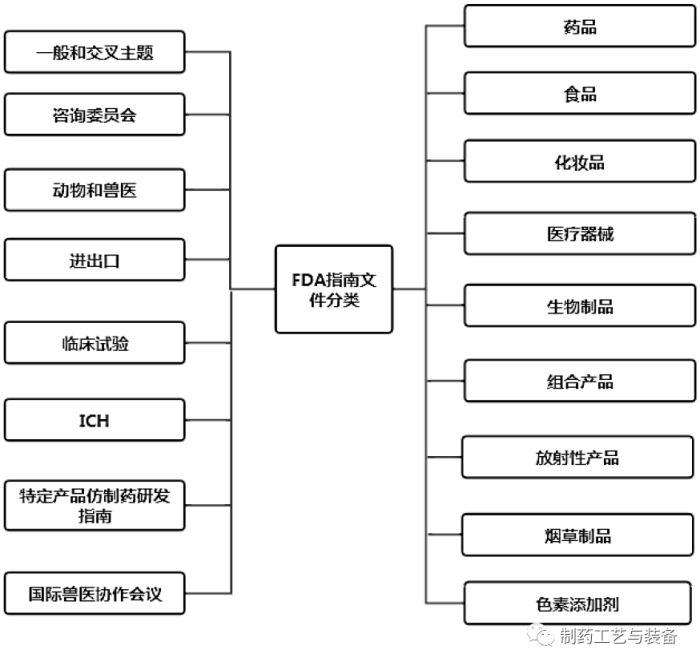
在FDA指南数据库中,根据所涉及的内容不同,FDA发布的所有指南文件被分为17个主题(见图1)。其中,药品又分为广告、标识签、生物类似药、组合产品、非处方药(Over The Counter,OTC)、罕见病、真实世界数据/真实世界证据(RWD/RWE)等38个分支主题[15]。FDA指南文件数据库具有关键字检索功能,也可以根据产品类型、发布日期、发布机构和文件类型进行筛选、检索。公众还可以根据指南的主题进行分类浏览,且所有指南文件均可查阅和下载。
图1 FDA 指南文件分类
目前,在国家医药政策的深入改革进程中,国内医药相关数据库也处于蓬勃发展之中。在我国医药数据市场上,国际软件巨头占据了绝大多数的份额,国内的阿里巴巴、东软等企业也在医疗数据领域有所发展[16]。我国的医药相关数据库大致可以分为政府主导、企业主导两类。
政府主导的医药数据库,主要为国家市场监督管理总局、国家药品监督管理局等在其各自官方网站上建立的数据库,此类数据库内容真实准确,且具备权威性。国家市场监督管理总局网站不仅涵盖药品监管法规,还包括食品、广告等其他领域的法律法规和其他文件。
近年来,随着我国药品监管法规体系不断完善,药品监管法规文件数据库的建设受到了监管部门的高度重视,逐步建设并更新了多个由政府主导的数据库。但是,现有数据库在其结构、功能及资源方面尚存在需完善之处,不能完全满足公众高效、便捷地查询药品法规文件的需求。在结构方面:现有的分类标签较少,用户无法快速精准定位,且不同网站数据库对法规文件的分类方法不一;在功能方面:即使输入有效关键词进行查询,但检索出的信息相关度较低,检索效率不高;在资源方面:法规文件分散于各个不同的政府或事业单位网站,公众尚无法实现“一站式检索”。
由企业主导的数据库,如Insight、药智数据、医药魔方等,一般重点聚焦于药物研发、药品申报和药品使用等数据,能够查询的药品监管法规文件数量较少,且缺乏权威性,即使显示了法规文件的全文,用户仍需自行转向政府网站来实施二次搜索,以确保其真实性,增加了工作量。
对我国建立更加系统、科学的药品监管法规文件数据库的启示
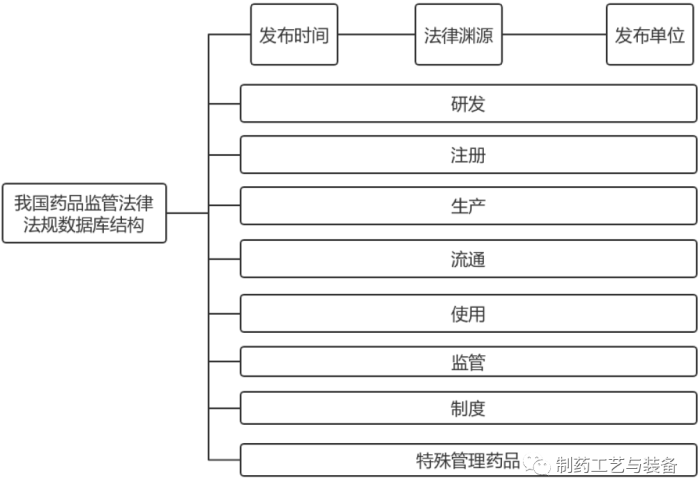
我国法规文件具有发布单位多、法律效力层级复杂等特点,在设计数据库结构时应以便于检索为原则,将法规文件从多个维度进行分类。首先,可分别按照法规文件发布时间、法律渊源和发布单位进行横向分类;其次,可根据药品的生命周期进行纵向分类,包括研发、注册、生产、流通、使用等。此外,我国近年来不断完善药品监管制度,可将“监管”(药品的审评、检查、检验等)、“制度”(包括药品上市许可持有人制度、优先审评审批制度、药物警戒制度、药物追溯制度、原辅包管理制度、一致性评价制度、假劣药管理制度和行刑衔接制度等)以及特殊管理药品(麻醉药品、精神药品、毒性药品、放射性药品等)单独分类,从而更便于公众按照需求检索法规文件(见图2)。
图2 我国药品监管法规文件数据库结构图
为保证药品监管法规文件数据库的权威性与完整性,应优先从政府主导的相关数据库获取资源。对于各部门发布的药品法律法规文件,可按法律渊源的类别作为纳入标准。其中,对于药品相关的地方政府规章和地方性法规,可设立单独板块,按照34个省级行政区(包括23个省、5个自治区、4个直辖市和2个特别行政区),将与药品相关的地方政府规章和地方性法规等文件分类整理。而且,药品监管法规文件数据库的资源不应仅局限于国内药品法律法规文件,还可链接美国、欧盟、英国及ICH等国家和组织的法律法规数据资源,从而建立一个权威、全面、国际化的药品监管法规文件数据库。
为保证药品监管法规文件数据库的时效性,建议定期检查有关资源网站,例如:国务院政策咨询文件库、司法部行政法规库等,及时进行文件更新,并在页面上标注最新更新时间。此外,还应设置外部链接区域,以便用户可以直接跳转到法规文件的发布单位网站。
针对药品监管法规文件数据库的检索功能,建议采用“目录导航” “快速搜索” “高级检索”和“热门搜索”相结合的检索功能。“目录导航”模块可包括研发、注册、生产、流通、使用、监管、制度和特殊管理药品等细分选项。“快速搜索”应包含“关键字”搜索、“字段”搜索以及“法律发文字号”搜索等功能,以提高检索法律法规文件的精准度。“高级检索”功能应涵盖包括近似搜索、布尔逻辑检索等检索方式,同时数据库还应提供“日期范围”(发布日期和实施日期)、“时效性”“法律渊源”和“发布单位”等筛选项,以帮助用户缩小检索范围,精确锁定目标文件,提高检索效率。“热门搜索”功能可以根据近期热点,生成并及时更新“热搜关键词库”,保证时效性与实用性。
药品监管法规文件数据库应不仅支持在线阅读文件,还应支持多种版本的下载功能,包括PDF、XML、DOC等格式。此外,由于一些法律法规文件的篇幅较长,用户在检索到法律法规原文后,还需要自行查找所需条款。因此,应在检索结果分为“全文”显示和“相关条款”显示的基础上,提供以“章”“条”下载的功能。
药品监管法规文件数据库应密切关注各级政府的官方网站、国际有关机构与组织网站,及时获取药品相关的法律法规更新信息,定期更新数据库资源,并在页面底部标明页面更新时间,从而使用户了解最前沿、最权威的法律法规信息。出于全面性的考虑,还应保留不同历史版本的法律法规,但应在标题中明确标识发布时间及是否废止等信息,以便公众和行业专业人员的查询和研究。
通过对美国药品监管法规文件数据库进行调研,分析我国药品监管法规文件数据库的现状和存在的不足,从结构、资源和功能方面提出建议,为在我国建立更加系统、科学的药品监管法规文件数据库提供了参考,具有现实指导意义。
[1] 国家药品监督管理局. 2020年政府信息公开工作年度报告[EB/OL].(2021-01-28)[2021-09-07]. https://www.nmpa.gov.cn/newzwgk/zfxxgknb/2020nb/index.html.
[2] 国家药品监督管理局. 2019年政府信息公开工作年度报告[EB/OL].(2020-01-31)[2021-09-07].https://www.nmpa.gov.cn/newzwgk/zfxxgknb/20200131152501262.html.
[3] 国家药品监督管理局. 2018年政府信息公开工作年度报告[EB/OL].(2019-03-29)[2021-09-07].https://www.nmpa.gov.cn/newzwgk/zfxxgknb/20190329153101648.html.
[4] 申杨. 以信息化引领药品监管现代化[N]. 中国医药报,2021-08-30(001).
[5] 王鑫,甄橙. 美国药品监管法规百年历程及对中国的启示[J]. 中国新药杂志,2016,25(8):849-854.
[6] 王晓,杨牧,王璐,等. 欧盟与中国药品法律法规及检查体系对比分析[J]. 中国药业,2020,29(10):60-64.
[7] 孟八一. FDA药物监管权力结构简析[J]. 中国食品药品监管,2019(7):46-55.
[8] National Archives. About Laws[EB/OL].(2017-12-28)[2021-08-26]. https://www.archives.gov/federal-register/laws.
[9] FDA. Laws Enforced by FDA[EB/OL].(2018-03-29)[2021-09-02]. https://www.fda.gov/regulatory-information/laws-enforced-fda.
[10] FDA. Federal Food, Drug, and Cosmetic Act(FD&C Act)[EB/OL].(2018-03-29)[2021-09-06]. https://www.fda.gov/regulatory-information/laws-enforced-fda/federalfood-drug-and-cosmetic-act-fdc-act.
[11] FDA. Selected Amendments to the FD&C Act[EB/OL].(2018-03-29)[2021-09-06]. https://www.fda.gov/regulatory-information/laws-enforced-fda/selectedamendments-fdc-act.
[12] National Archives and Records Administration. A Brief History Commemorating the 70th Anniversary of the Publication of the First Issue of the Federal Register March14, 1936[EB/OL].(2014-06-11)[2021-08-29]. https://www.archives.gov/files/federal-register/the-federalregister/history.pdf.
[13] 王越,周良彬,王悦,等. 美国和日本医疗器械数据库系统构建思路探析[J]. 中国药事,2019,33(10):1181-1186.
[14] FDA. Fact Sheet: FDA Good Guidance Practices[EB/OL].(2019-12-04)[2021-08-29]. https://www.fda.gov/about-fda/transparency-initiative/fact-sheet-fda-goodguidance-practices.
[15] FDA. Guidances(Drugs)[EB/OL].(2021-09-03)[2021-09-07]. https://www.fda.gov/drugs/guidancecompliance-regulatory-information/guidances-drugs.
[16] 新浪医药新闻. 国内各类医药数据库的发展现状[EB/OL].(2017-02-22)[2020-08-12]. https://med.sina.com/article_detail_103_2_20740.html.
撰稿人 | 张静、关月月、揣红梅、唐桃群、潘威、杨悦
责任编辑 | 胡静
审核人 | 何发













评论
加载更多