高浓度蛋白制剂及皮下注射给药
高浓度蛋白制剂
高浓度蛋白制剂主要用来描述高浓度的单抗药物制剂。目前,对于高浓度蛋白制剂的浓度没有明确的定义,大多数文献中将浓度≥100mg/mL的蛋白制剂定义为高浓度蛋白制剂。
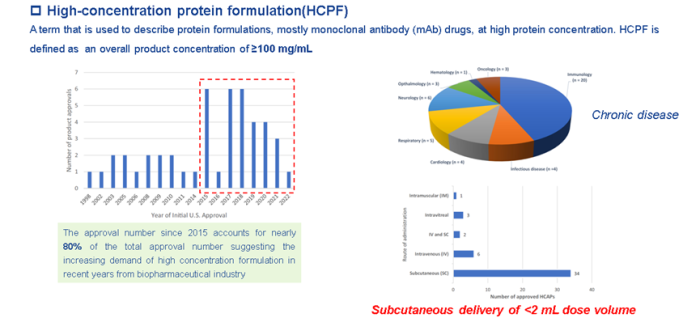
自1986年首款单抗药物面世以来,有超过46款高浓度抗体制剂获批。尤其是2015年以来,获批高浓度单抗制剂占总获批抗体制剂的近80%。
为什么现在越来越多的制药公司开发高浓度蛋白制剂?从这些高浓度蛋白制剂的治疗领域和给药途径我们可以一窥究竟。46款获批的高浓度蛋白制剂主要应用于免疫、神经、心血管等,这些疾病大多是慢性疾病,需要长期用药。给药途径则主要是通过皮下注射的方式。一般单抗药物的治疗剂量都较高,约50-700mg的用量,而通常情况皮下给药的最大剂量小于2mL(主要是为了减轻注射部位的疼痛),这就需要高浓度的蛋白制剂。
皮下注射给药
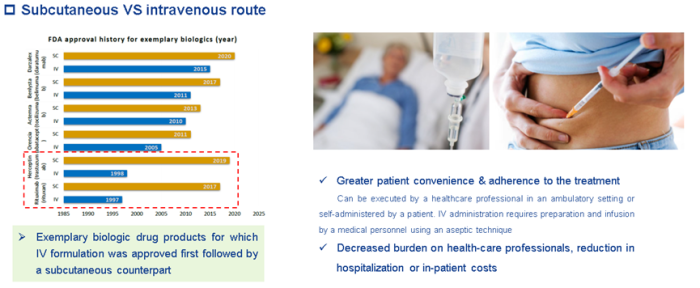
对于慢病,为什么制药公司喜欢皮下注射制剂呢?这是因为与静脉注射给药相比,皮下注射给药有诸多优点,例如增强患者的依从性和提高便利性、减少医疗负担、节约成本和医疗资源等。
罗氏的利妥昔单抗和曲妥珠单抗在获批20多年后又推出了皮下注射制剂。这也是公司在生物类似药不断蚕食自己的销售份额的情况下通过改良制剂来增加销售额的一种方式。
高浓度蛋白制剂的挑战
皮下注射给药虽然有诸多好处,但是对于单抗这类生物大分子来说,高浓度的蛋白制剂又存在诸多挑战。
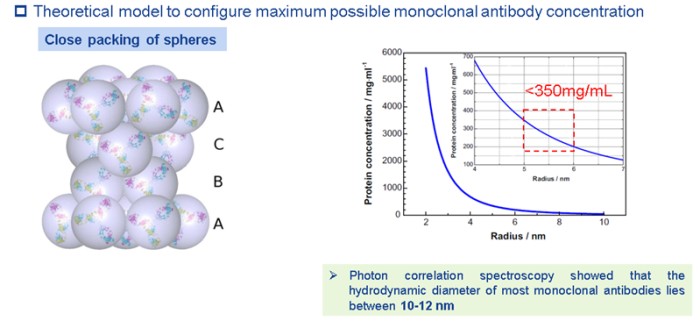
研究人员通过使用紧密球形堆积模型,预测了单抗制剂的理论最高浓度可以达到350mg/mL。这个预测值是把单抗分子看成是一个直径为10nm的球体推测出来的。
首先制备高浓度蛋白制剂的过程中存在挑战。对于液体制剂,一般通过超滤的形式实现高浓度,这其中会存在因为浓度升高带来的粘度增加,蛋白自缔合及聚集引起的背压增大,进而引起过滤速率的降低,还有会引起渗透压的升高。对于冻干制剂,会存在复溶时间增加和产生物理不稳定性等问题。
其次,生产的高浓度制剂还可能存在可注射性的问题。例如,一个高浓度制剂的粘度在20-30cp的时候,使用30G的针头注射时需要80N的力,也就是一个8公斤重物体的重力。还存在蛋白溶解性,胶体和结构稳定性等问题。
最后,对于高浓度蛋白制剂的分析好多项目通常需要稀释步骤才能进行,这有时候不能反应高浓度时的情况。

皮下注射药物递送及开发联盟

皮下注射药物递送及开发联盟成立于2018年,旨在从根本上改善皮下药物的开发和递送。在这一共同目标的激励下,成员们齐聚一堂,解决皮下行业的关键问题,并扩大皮下技术的使用,以改善患者的治疗效果。
为了实现这一目标,皮下注射药物递送及开发联盟专注于将不同社群(即工业界、学术界、监管部门、付款人等)的不同关键成员聚集在一起,共同分享他们各自的专业知识和经验。
皮下注射给药的新方法
下表所示为皮下注射药物递送及开发联盟在发表的一篇文章中列举的新的高浓度制剂皮下给药的新方法。
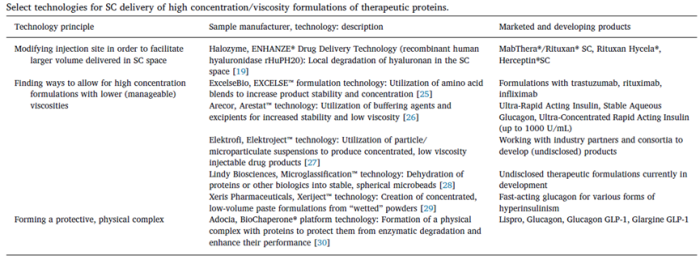
修饰注射部位
Halozyme公司是一家平台技术开发公司,他们公司的ENHANZE®药物递送技术可以将人重组透明质酸酶与药物做成复方制剂,而人重组透明质酸酶可以分析皮下致密的透明质酸层,进而有更多的空间可以用来装填注射的药物,增加注射体积。使用该技术,可以将给药体积增加到10mL。此外,该技术还有增加药物的吸收效率、生物利用度、最大血浆浓度和加速药物浓度达峰的时间等优势。

罗氏的好几款高浓度蛋白制剂就是使用该技术实现皮下注射给药的。
糊剂
这一技术是由Xeris公司开发的,从专利中可以知道大概的流程是首先使用喷雾干燥或者冻干,然后通过研磨形成微米级的粉末颗粒,最后使用苯甲酸烷基酯、苯甲酸芳基酯、芳烷基苯甲酸酯等非质子极性溶剂与粉末混合,形成高浓度蛋白糊剂。
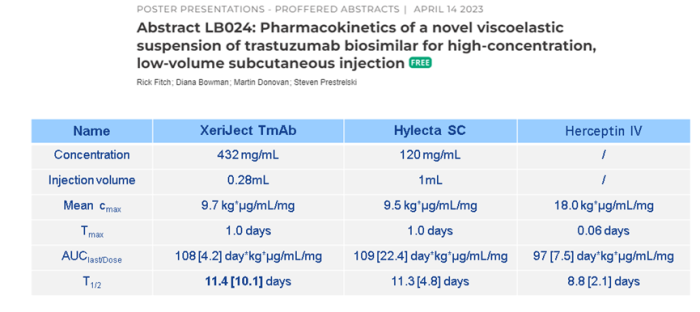
他们公司将该技术制备的高浓度制剂与普通高浓度液体制剂的曲妥珠单抗进行了PK比较分析,发现两者不管是在平均血药浓度,最大达峰时间、半衰期等方面都具有可比性。但是我们也可以看到,该技术制备的高浓度制剂在半衰期方面的误差比较大,也就是个体差异性存在较大差异。
总结
现在的制药公司不仅在靶点上越来越卷,在制剂上也是越来越卷。随着对于高浓度蛋白制剂的需要越来越多,相信会有越来越多的技术和方法出现来解决现阶段遇到高浓度制剂所带来的挑战。
参考文献:
1. Ghosh I, Gutka H, Krause ME, Clemens R, Kashi RS. A systematic review of commercial high concentration antibody drug products approved in the US: formulation composition, dosage form design and primary packaging considerations. MAbs. 2023 Jan-Dec;15(1):2205540.
2.Badkar AV, Gandhi RB, Davis SP, LaBarre MJ. Subcutaneous Delivery of High-Dose/Volume Biologics: Current Status and Prospect for Future Advancements. Drug Des Devel Ther. 2021 Jan 13;15:159-170.
3.Garidel P, Kuhn AB, Schäfer LV, Karow-Zwick AR, Blech M. High-concentration protein formulations: How high is high? Eur J Pharm Biopharm. 2017 Oct;119:353-360.
4.Collins DS, Sánchez-Félix M, Badkar AV, Mrsny R. Accelerating the development of novel technologies and tools for the subcutaneous delivery of biotherapeutics. J Control Release. 2020 May 10;321:475-482.
5.Locke KW, Maneval DC, LaBarre MJ. ENHANZE® drug delivery technology: a novel approach to subcutaneous administration using recombinant human hyaluronidase PH20. Drug Deliv. 2019 Dec;26(1):98-106.
6.https://halozyme.com.
撰稿人 | 质控实验室
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多