口服固体制剂生产和工艺研发过程中的相变考量
口服固体制剂的疗效和品质主要取决于固相(晶型)的选择、剂型的设计及其生产工艺。在设计和开发剂型及其生产工艺时必须充分考虑由生产工艺导致相变的可能性。本文简要综述了多晶型的基本原则,明确了相变的类型及潜在的转变机制并分别讨论了各类型(相变)的动力学因素。着重强调了口服固体制剂常见单元操作与潜在相变可能性的关联。并以实例阐述固相以及剂型和工艺开发过程导致相变的重要性。
口服固体制剂有着方便、物理化学性质稳定、便于管理、高通量及生产成本低的优点。口服固体制剂中的API和辅料可以以不同晶型或是无定型的形式存在。当固体制剂中API事先选定的固相形式或晶型辅料经受制剂生产过程中各种不同环境时,可能会发生诸如晶型、溶剂化物/水合物及无定型之间的相变。
众所周知,晶型的不同会引起固体物理、化学及机械性能的改变。因此必须充分理解API和辅料的固态性质以保证产品的疗效稳定。考虑到药品工艺开发过程药物晶型选择的重要性,药物科学家们从对理解多晶型的现象到对特定晶型的实际利用等多方面进行了不遗余力的研究。虽然目前已可对不同晶型进行鉴别和表征,并可选定特定晶型进行研究,但确保成品中的药物晶型未发生变化仍是非常重要的。像加热、研磨及暴露于溶剂中等在生产过程的单元操作,可能会出现利于转晶的条件。因此在制剂和工艺开发过程必须考虑出现转晶的可能性。
Morris等提出了制剂工艺相变的理论方法。该篇文章从另一方面着眼于这一主题的实际应用。本文对生产工艺单元操作可能引起的相变、潜在机制、预期或如何防止及相变对药物品质的影响均会被论述。最后,以实例论证理解工艺如何导致相变的重要性以及制剂和工艺开发过程中的存在的挑战
关于固相的形式已在其他多种论著中被详细讨论,在即仅做以下简单总结。固相被分为晶型和无定型两大类。多晶型是固态物质的晶体形式含有相同的分子或离子但具有不同的构象和(或)堆积方式。溶剂化物是溶剂分子存在于晶格中并与“宿主分子”(host molecules)加合而形成的一种晶体形式。如果溶剂是水分子则被称为水合物。水合物尤其与药物的研发相关,因其在生产过程中普遍存在。与晶体形式具有三维长程有序排列不同,无定型态不存在可被识别的晶格,可被视为过冷液态。
这些不同的固相形式均具有独特物理、化学及机械性质,并且(性质)相互之间彼此关联。例如,在一定的溶剂中,高的热力学活性意味着更高的表观溶解度,在该溶剂中便存在着扩散为限速步骤的更快的溶出速率。高的热力学活性意味着更高的反应活性导致稳定性降低。虽然存在意外,但一般而言遵循上述规律。根据上面提及的不同性质之间的关联,不同相态之间的差异可能会被进一步放大。例如,在干燥状态下由于高的热力学活性无定形态一般比相应的晶态形式具有更高的反应活性。此外,潮湿环境下,无定型吸湿性更大,吸收的水分可作为增塑剂显著增加分子的运动性。因此,与晶态相比,暴露于潮湿环境,无定型态的稳定性更易受到影响。
此外,根据温度、压力和相对湿度等的不同,同一物质不同晶态之间相对的稳定性也会发生变化。在产品开发过程中,不仅要能区分不同晶型,在可能引起转晶的相关环境下还要能做到意识到它们之间的转变。对相变机制的认识非常有助于识别这些可能的转变以及影响这些转变的动力学因素。对这些机制的理解对也有利于剂型的合理设计和选择耐用性好的工艺,从而保证产品生产质量和疗效的一致性。表1列举了四种可能的相变机制,并分别进行讨论。
表格 1 相变及可能机制
2.1.1固相
有些相变未经过液相或气相的短暂临界状态而是直接在固相之间发生。许多动力学方程已被用来描述固相相变的动力学机制,其中每一条均代表着一种特别的机制[11-13]。最近一种被称为“自由态模型”(model free)的方法被应用于水合物脱水[14]和无定型晶体化转变[15]。这种新的方法可以更灵活的解释(相变的)动力学过程并提供更强大的预测能力。此外这种方法也有助于说明相变过程的动力学机制,特别是对那些机制复杂的过程。一般而言,固相相变的机制受到环境因素(压力、温度、相对湿度等)、晶格缺陷、粒径和粒度分布及杂质等的影响。
2.1.2融化
当化合物在高于熔点的情况下进行加热随后冷却至室温后,可能不会再生为原来的固相状态。因此,在这种加热/冷却的循环过程中,可能会发生相变。在影响物质最终固相状态的众多因素包括成核的速度、晶体生长以及冷却等。其中杂质和辅料也可能影响结晶的过程。
2.1.3溶液
在工艺过程中,药物溶解或部分溶解在溶剂(典型的如水)中是非常普遍的情况。如果在除去溶剂的过程中引发了相变,则这种机制被称为溶液机制。意识到相变可以是亚稳态向稳态或稳态向一种或多种亚稳态之间进行转变这一点是非常重要的。比如,在湿法制粒过程药物可能部分溶于水中,在冻干会喷雾干燥过程中药物则完全溶解在水中。一旦除去溶剂便会再生出固相的药物。再生药物的固相状态可能已不是原来的晶型或者为混晶状态。需要注意的是只有溶解的那部分药物才可能发生相变。
最终的固相状态是单一相态还是无定型以及晶型的混合取决于溶剂取出的速率、晶核形成的难易以及在相应工艺环境下可形成晶型的晶体生长速度等因素[16]。
2.1.4溶液介导
与溶液机制不同,溶液介导机制只会引起亚稳态向稳态的相变。该种相变是两种相态下溶解度的不同导致的。与溶液机制的相变发生在干燥过程不同,溶液介导机制的相变在亚稳态接触到饱和溶液时发生。
在溶液介导机制的相变中存在三个连续的过程[17-19]:1)亚稳相态溶解于所接触到的饱和溶液并达到稳定相态的过饱和状态;2)稳定相态的成核;3)稳定相态的晶核生长同时伴随亚稳状态的不断溶解(过程1)。过程(2)和(3)往往是限速步骤。当过程(2)为限速步骤时,任何影响成核的因素均会影响整体的相变过程。这些因素包括溶解度和溶解度差异、工艺过程的温度、接触面积、搅拌以及可溶性辅料/杂质等。当步骤(3)为限速步骤时,相转变的动力学取决于溶解度差异、固相与溶剂的比例、工艺过程的温度、起始物相(晶核)的粒径、搅拌以及可溶性辅料/杂质等。
上面讨论的四种常见机制可引起三种类型的相变:多晶型、水合/脱水、玻璃化转变/无定型晶体化转变。以下将会详细讨论。
2.1.4.1 多晶型转变
多晶型转变意味着不同晶型间的互变。根据“一对”多晶型之间的稳定关系可以分为单变晶体和双变晶体两大类。两种类型多晶型系统的热力学相图如图1所示。
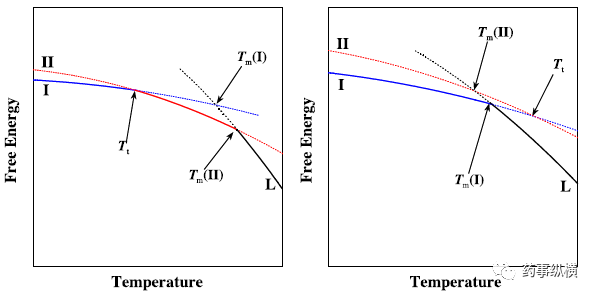
图表1 单变晶体(右)和双变晶体(左)的热力学相图
对于双变晶体而言,一种晶型在低于相变温度(transition temperature ,Tt)时温度,另一种则在高于相变温度时稳定。对于单变晶体而言,在整个温度范围只有一种稳定晶型存在。
单变晶体 当一种亚稳态的晶体被使用时,在工艺过程中上面的四种机制均可引起向稳态晶体转变的过程。如果是固相相变机制引起,由于分子运动很慢这种转变是动力学 “禁止”的。通过加热或施加机械力(干燥、研磨、压缩等)的方式可加速向稳定晶型转变的过程。当载药很少或者溶剂对药物溶解性好时则可能发生溶液机制引发的相变。相反,载药很高时进行湿法制粒或溶剂对药物溶解性差时可可能发生溶液介导机制引发的相变。从稳定晶型想亚稳型的相变只可能发生在融化或溶液机制中。
双变晶体 在加热过程中如果未达到相变温度,那么双变晶体则实际表现为单变晶体。但如果超过了相变温度那么相变可能通过四种机制中的任何一种发生。需要注意的是,对于固相机制的相变而言,在相变温度附近,更可能出现过冷而非过过热现象,因为分子的运动需要依靠大量的热量[21-22]。因此在加热过程中,温度高于相变温度的前提下,向低温度的亚稳态晶型(高温度的稳态晶型)的转变发生后,在随后的冷却过程中是不可逆的。
对于单变晶体系统和双变晶体系统而言,在整体的相变过程中可能会发生一系列的相变,如相变可能以水合过程开始随后经历脱水过程或者以玻璃化转变开始随后经历结晶过程。
水化和脱水 这种类型的转变是指无水物和水合物之间或者低结晶水水合物和高结晶水合物之间的相变。不同化学当量的水合物间的稳定性如图2表示的恒温相图所示。恒温条件下,在一定的水蒸气活度(相对湿度,RH)范围内某一晶型是稳定的。在临界湿度下,无水物/水合物或者低化学当量水合物/高化学当量水合物是可以共存的。由于动力学的因素往往形成亚稳态的过渡状态,特别是对于水化过程而言。
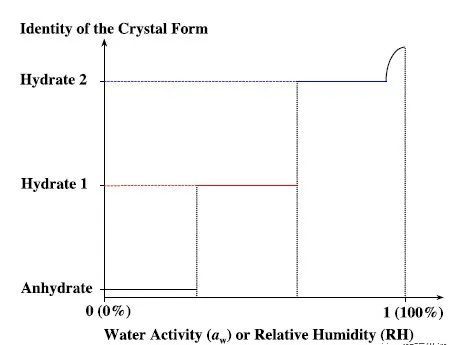
水化过程一般为溶液或溶液介导机制发生。对于API占比高的制剂而言更可能发生溶液介导机制的过程。对于通道型(channel-type)水合物而言,可能会发生固相机制的过程。脱水过程可通过固相或溶液机制,也是也可能为融化机制。需要注意的是,不同化学当量的水合物脱水[22]或者同一水合物在不同条件下脱水[23-24]会导致化合物不同的物相。在受到外力的情况下,如研磨等,可能会由于产生新的接触面或晶格缺陷以及局部产热等原因而加速脱水过程。
玻璃化转变及无定型晶体化 这一相变指的是无定型和晶型以及无定型和水合物间的互变。图3表示了无定形态和其相应晶体无水物间的热力学能图。借用多晶型相变中的术语,无定形态类似于“单变晶体系统”中的亚稳态。因此,在任何温度下无定形态都存在通过固相、溶液或溶液介导机制向晶体转变的倾向。高载药制剂长时间制粒或溶剂对药物溶解性差的条件下更可能通过溶液介导机制进行转变。
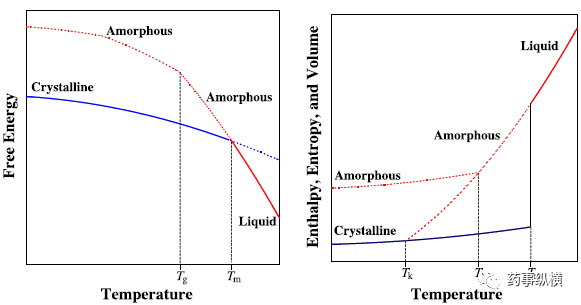
由于比晶体具有溶解度优势,无定型在药物递送中变得越来越重要[25-26]。因此过去十多年对无定型的物理稳定性有了更深入的理解。无定型晶体化过程的动力学主要由分子的运动性决定[27]。随着温度的升高,特别是在高于玻璃化转变温度(glass transition temperature ,Tg)时,分子运动性提高可显著增加无定型向晶体转变的可能。Kauzmann 温度是指晶体的熵与过冷液体的熵相同时的温度(Kauzmann佯谬)[28-29]。
由于熵可以与分子的运动性进行关联,无定型制剂的稳定必须在(或者低于)Kauzmann 温度[30-31]。然而表现为分子构象焓的分子的复杂性在决定无定型晶体化的倾向时同样重要[32]。此外,在低于Kauzmann 温度时,被定义为构象自由能晶体化驱动力并未改变[33]。另外,环境湿度也以多种方式影响着无定型的晶体化。首先,可以作为增塑剂减低Tg,增加分子流动性[34,35]。其次,可以作为“反溶剂”(anti-solvent)改变固体分散体的组成提高晶体化的驱动力。
玻璃化转变是晶体转变成无定型的过程[36],经常通过融化或者溶液机制。在两种机制下,晶体成核速度或晶体生长速度均慢与冷却速度或去除溶剂的速度。玻璃化也常常在受到机械压力或失水时通过固相机制发生[37-39]。
许多技术可以用来进行固体表征。常用分析技术的优缺点如表2所示。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
“暗箱”:没有相变的本质信息;受晶型和无定型辅料的干扰
|
|
|
|
|
|
|
相态识别的补充手段;可区分水的不同状态;与显微镜联用只需少量样品
|
|
|
|
相态识别的补充手段;可区分水的不同状态;可穿透容器检测
|
|
|
|
相态识别的补充手段;样品量少;可穿透容器检测;基本不受水分影响
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
为了对API进行最优的表征,不同功能的辅料也往往包含在制剂中。这种混合物给固体的分析带来两个主要挑战。第一个是检测限。因为不像水相检测那样灵敏,随着药物比例降低,识别和区分不同晶型变得困难。定量分析则比定性分析遇到的难度更大。第二个便是辅料的干扰。正如表2所示,辅料的干扰会限制许多仪器的运用。但干扰的程度也视化合物和剂型而定,因此不同情况需区别对待。
最近过程分析技术(PAT)由于可以实时监控生产过程而备受瞩目[40]。该技术在方法专属性、鉴别方面仍有大幅提升的空间。
API被制成含有辅料的固体片剂或胶囊以改善其可加工性、提供疗效和美化外观等。生产出临床批制剂后,必须通过GMP通过对原料、工艺过程、设备、厂房、成品剂型及包装等多个环节的控制尽量减小批次间的差异。根据分子的物理和化学性质,可能需对制剂的成分、生产工艺及API的固相形式进行改变。这些改变可能会对产品的质量和疗效造成无法预期的后果。为了预测和防止这种产品不一致性,必须对API和辅料的物理化学性质进行全面充分和研究。选择合适的辅料并进行质量控制以及产品的生产工艺也同等重要。
一个固体制剂的主要重要产品属性主要包括稳定性、溶出度、生物利用度、外观、生产加工性、密度及硬度等,所有这些均可能被相变所影响。一般来说,对于溶解度差的药物相变主要关注溶出度/生物利用度,因为相变可能会引起溶解度的改变及制剂中API其他性质的变化(粒径等)。对于可溶和难容分子来说,相变对两者的稳定性和可加工性都有影响。
为了确保产品货架期内质量和疗效的一致性,一般倾向于选择热力学稳定的晶型作为起始物料。如果亚稳型和无定型已证明在贮存条件下是稳定的,也可用来提高产品的溶出度和改善加工性。如前说述,化合物的物理稳定性很大程度上取决于环境条件。加工过程,API处于温度压力和湿度均不断变化的环境中,工艺引起的相变是可能发生的。为了确保产品的一致性,特别是对难溶性药物而言,一定要知道最终成品中API的固相存在形式。
根据API和工艺环境的不同常见的工艺引起的相变主要形成有部分或完全的亚稳晶型、无定型、水合物/溶剂化物或去溶剂化等。不同稳定性和溶解性的亚稳晶型之间的缓慢转变或随着时间推移亚稳晶型向热力学稳定晶型的转变可能引起产品在储存过程中溶出和稳定性等的各种变化。虽然在特定环境下无定型是物理稳定的,但一般而言其具有更差的物理稳定性、更大的溶解度及更高的化学反应活性。无定型药物和辅料的重新晶体化也可能影响片剂的其他性质(硬度、崩解及溶出等。API水合/脱水的循环过程可能形成1)亚稳或稳定性晶体;2)无定型3)包括水合物或溶剂化物在内的各种混晶形式。所有这些相变均会对产品质量产生重大影响。
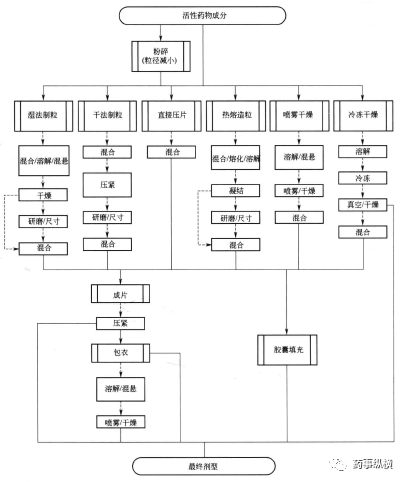
在许多参考文献和论著中对口服固体制剂生产工艺有全面的描述[41-43]。图4总结了常见的方法和与之相关的单元操作。这些工艺过程对固态相变的影响和相应的挑战本文将陆续讨论。
3.2.1 减小粒径
固体制剂生产的第一步往往是减小原料药粒径。减小粒径可以为后续工艺过程提供便利同时可提高产品的活性(通过改善形态/流动性、降低分离趋势、提高均一性、增加表面积等)。研磨是减小粒径的基本方法,该过程主要通过对药物粒子施加剪切/切割力、压缩、冲击力及颗粒自身的磨损等达到目的。冲击式粉碎机(锤式粉碎机等)和流能磨(气流粉碎机等)在制药工业有着广泛应用。其他减小粒径的方法包括超临界流体技术等[44],往往并不常用在此不做论述。
冲击式粉碎机主要施加机械压力并往往伴随着产热,可能会引起诸如失水、固相相变机制或融化机制的玻璃化转变等多种相变。相变的程度和速度往往取决于物料的初始相态、粉碎机类型及粉碎条件等。有关于地高辛、螺内酯和雌二醇等在粉碎过程发生多晶型转变的报道[42]。多数情况下,在与辅料进行混合前往往需要相对原料药进行粉碎,因此相对制剂的表征而言,粉碎后原料药相变的情况和程度要简单的多。
3.2.2制粒/增加尺寸
在粉末被压缩成片剂或填充进胶囊之前必须具有流动性、粘附性、可压缩性及润滑性等多种物理特性。由于大部分物料不会同时具备所有特性,因此需借助造粒技术赋予物料上述性质。对片剂和胶囊的生产而言主要有两只制剂技术:1)湿法制粒;2)干法制粒。其他制粒工艺包括喷雾干燥及熔融高速搅拌制粒、喷雾凝结制粒和热熔挤出制粒等热熔造粒技术。
3.2.2.1湿法制粒和干燥
湿法制粒由于其适用性及获得后续工艺所需颗粒物理性质的较大可能性,是目前应用最为广泛的技术。主要包括低速/剪切制粒、流化床混合及造粒(挤出和滚圆等)[41]。湿法制粒一般通过烘箱干燥、流化床干燥及真空干燥等方式来进行。其他干燥方法还包括微波干燥、隧道干燥及旋转气流干燥等[43]。虽然适用性广泛,但湿法制粒往往带来相变的问题。可能的相变不仅取决于物料自身性质还与制粒及干燥的方式和条件有关。
根据制粒和干燥方式等的不同,加液量、在液体、气流和干燥温度下的暴露时间等条件均有差异。载药量的大小、药物在润湿剂(粘合剂)中的溶解度及制粒过程决定了起始物料的固相是部分还是完全溶解。随后溶剂去除的速率取决于制粒和干燥的方式,该过程可能会影响干颗粒相态的形成。除了API性质之外,制粒及干燥的条件和方式也会影响相变以溶液还是溶液介导的机制发生,如多晶型转变、水化/脱水、玻璃化/晶体化等。如果药物完全溶解在制粒液中,干燥的方式和选用的辅料将决定相变是否通过溶液机制发生。如果难溶性药物分散在制粒液中,则无水物倾向于通过溶解介导机制转变为水合物。对相变的检测能力和相应可采用的分析手段取决于载药量的多少和辅料的干扰程度。
3.2.2.2干法制粒
当制剂成分对水分敏感或者无法承受干燥所需的温度时一般采用干法制粒。如果处方成分固有键合力或内聚力很强时也会应用干法制粒技术。干法制粒也被称为预压或二次压缩技术[41]。压片法和辊压法是干法制粒常用的两种方法。由于滞留时间的不同压片法施加的压力可能小于辊压法。由于该过程不使用制粒液因此也就排除了溶液或溶解介导可能引发的相变进而降低相变的可能性。该过程施加的加大机械力则可能导致固相或融化机制的相变。与湿法制粒技术一样,干法制粒过程对相变的检测能力和相应可采用的分析手段同样取决于载药量的多少和辅料的干扰程度。
3.2.2.3熔融造粒
熔融造粒过程首先部分或完全将固体辅料溶解,随后与API和剩余辅料一起制粒,最后通过冷却和凝结的方式降低粒径。该过程中API受热可能部分或完全溶解在熔融状态的辅料中。如果API熔点相对低或加热的温度足够高,API在制粒过程则可能融化。部分或完全融化的API也可充当粘合剂或固化载体的作用。随后的冷却过程可能会经历固相或融化机制的相变。事实上,有时通过融化机制采用该过程用来制备晶体或无定型的固体分散体。
在喷雾-冷凝过程中,一般采用低熔点的载体以满足喷雾所需的流动性。在较高温度下,药物可能部分或完全溶解在熔融态的载体中。在喷雾-冷凝过程中,高温的液滴需要快速冷却固化,因为这是形成较小粒径且保证粒径分布较窄的必须条件,药物也可能遵循奥斯特瓦尔德阶段相律(Ostwald’s Rule Stages)以亚稳态晶型或无定型的形式沉淀[45,46]。在高剪切熔融制粒中,温度、加热的强度和时间、冷却的速度均显著低于喷雾-冷凝过程,引起相变的可能性也较小。与喷雾-冷凝类似,热熔挤出需将辅料完全熔融,虽然冷却过程相对缓慢,但仍可能出现相变。
3.2.2.4喷雾干燥和冷冻干燥
喷雾干燥会得到形态和粒径比较均一的高孔隙率粉末颗粒。该技术也用来对药物进行包裹或包衣以达到保护药物或控制释放速度的目的。该过程中,高度分散的液体在充足热空气的作用下形成均一的细小液滴,随后去除液体形成颗粒[41]。供给液可以是溶液混悬液或乳液。该过程要求药物完全或部分溶解,因此增加了溶液机制产生相变的可能性。细小液体中溶剂的干燥往往只需几秒钟,可能会通过溶液机制相变,快速形成亚稳晶型或无定型。
冷冻干燥通常用来制备无定型。在该过程需采用极低温度限制分子运动及药物和辅料的成核。冻干条件会显著影响药物在产品中的固相形态。虽然不是固体制剂的常用生产手段,但也被用来制备特殊功能片剂如Zydis®等[47,48]。
3.2.3颗粒研磨/过筛及混合
在该阶段经常需对颗粒进行研磨(整粒),但强度与粉碎时相比减小很多。虽然与粉碎和制粒过程相比,相比可能性大大降低,但辅料的存在时相变的检测变得困难。
在压片或灌装前需将颗粒与润滑剂或其他辅料混合(润滑剂、助流剂、崩解剂等),但并不改变颗粒物理性质。在混合过程发生相变可能性很小。
3.2.4压片和灌装
润滑后的颗粒进行压片或进行胶囊填充。压片过程中,在只有毫秒级的滞留时间下可能受到高达40KN的压力。施加这种级别的能量可能使药物或辅料经固相机制相变。有文献报道咖啡因、磺胺苯酰及盐酸马普替林会在压片过程发生多晶型转变[49]。胶囊填充过程由于固体受到热量和机械影响相对较小,很少发生相变。
3.2.5包衣
在制得片剂后,往往会在包衣锅或流化床中采用水基或溶剂基的高分子聚合物体系进行薄膜包衣。包衣的目的一般在于美化外观、掩盖味道及改善药物释放等。糖衣片及微丸等不常用包衣几乎再次不做讨论。薄膜包衣的过程是采用喷雾法将稀的高分子包衣液粘附在适当的底物上(片剂、颗粒或晶体)。
为了使得包衣材料分布均匀同时避免包衣出现的问题,需对包衣参数进行优化以维持包衣液传送速度和干燥能力的平衡。包衣过程一般快速干燥,高效率的气流交换确保包衣液和片剂表面只有短暂接触随后溶剂便被除去,以这种方式降低片芯和包衣液的相互作用。包衣过程中,大部分情况下不会发生溶液机制的相变。如有必要,在薄膜包衣前,可在片剂表面事先包一层高分子密封衣,以防止薄膜包衣过程可能发生的固-页相互作用。
对于改性释放制剂,总剂量中的部分药物可能会出现在包衣层中。该包衣层可作为两相缓释系统中的速释部分,或在脉冲递药系统中快速释药。根据剂量和药物的溶解度,含药包衣层通过喷洒含药溶液或混悬液于片剂表面制得。将药物溶解或分散在液体中增加了通过溶液或溶液介导机制发生相变的可能性。该过程对药物固相的影响与上文讨论的喷雾干燥比较相似。也就是说,在包衣过程中快速除去溶剂可能会导致亚稳晶型的快速析晶,或者通过溶液机制在含药包衣层中形成无定型。
充分了解API和辅料的晶型和无定型状态以及它们之间相互转化的机制和过程对预测和防止在生产中可能出现的相变是非常至关重要的。对这些信息的综合认知是合理选择API和辅料的物理形态、合适的生产过程、处理方式及储存条件所必须的。在一定的情况下,即使已经确定了固相的形式和工艺,对成品中所有原材料的晶型和物理形态进行监控仍是比较明智的。对于那些溶出和稳定性易受到相变影响的制剂这种监测就显得尤为重要。监测的严密程度则需根据API、剂型、工艺和分析方法等多方面而定。对于溶解性及稳定性好,生物利用度高的分子来说,工艺引起的相变对稳定性和生物利用度带来的风险相对较小。但是工艺引起的辅料或API的变化可能会对制剂的可生产性或崩解性能造成影响。
在选择何种API晶型进行开发的时候,必须综合考虑物理化学性质、生物药剂学性质及可加工性等多方面的因素。在某些情况下,为了消除稳定性、溶出速率差异及工艺引发的相变等问题,可能需选择备用的晶型。在API的生物药剂学性质及工艺特性满足需要的情况下,最好是选择最不易受到湿热及机械外力引发的相变影响的晶型。有时,可能选择拥有较少晶型的(备用)盐型以尽量降低工艺导致的相变的影响。
我们曾遇到个这样一种情形,出于临床因素的考虑,我们选择了(API)一种新的盐型进行I期研究。这种改变成功帮我们克服了(API)最初选择的盐型由于其复杂的多晶型相变而导致的在生产上存在的障碍。(API)盐型的改变显著降低了晶型的种类(由原来7种变为1种,7种里面4种为游离碱)。这种新的盐型降低了相变的风险同时为II期临床所需制剂的开发提供了更好的工艺可行性。
晶型辅料的相变及对机制的影响同样不容忽视。比如,对于含有较高比例如甘露醇等的晶型辅料的制剂,片剂在贮存过程中硬度变大(age-hardening)可能会导致溶出变慢的现象。如果工艺引起的硬度变大问题是可以预期的,那么便可提前通过外加或内外加崩解剂以及选择其他辅料等的方式加以改善,以尽量降低对溶出的影响。
在设计固体制剂生产工艺时,一般可通过处方前研究对工艺引起的相变进行一定的预测。同时也可以通过选择合适的工艺对相变进行规避和加以控制。如果一种固相对湿度或溶剂敏感那么可采用干法或熔融制粒工艺。如果API在粉碎或受到挤压是会发生相变,在其对热稳定的情况下则可以选择热熔挤出制粒。如果在原料药结晶时就可以对粒径和晶癖进行控制就可以避免对其进行粉碎。如果不宜进行压片则可选选择胶囊剂型。
将干燥温度控制在相变温度一下则可以避免互变晶型在干燥过程的相变。在薄膜包衣过程中,对于对水分敏感的片芯,可以在低速条件下采用低粘度溶液事先包裹隔离衣,避免或将片芯表面的固-液相互作用最小化。同样的可采用有机溶剂基的聚合物溶液体系包衣以达到快速去除溶剂的目的。这些仅仅只是将对API和辅料的固体性质的认知应用于处方和工艺开发中的少部分实例。处方和工艺的合理设计可以减少后期失败的风险从而提高新产品开发的效率。最后通过所选工艺生产出的成品必须通过检测以确保其品质。
如果在正常温湿度等条件下可以形成稳定的固相,那么在贮存过程中发生相变的几率则较小。如果稳定相态的物理化学性质不能满足需求,则可以利用工艺引发的相变在稳定的相态中引入含有(生产)所需理化性质的亚稳相态。例如固体分散体经常用于提高难溶药物的溶出度。对于晶型药物常常通过减小粒[51,52],或将其转变为高活性的无定型[53,54]来达到提高溶出速率的目的。虽然转变为高活性的无定型是提高溶出度的做有效手段,但无定型向稳定型转化的固有倾向是该方式的主要障碍。
开发无定型制剂的可能性主要取决于API的固有特性。最近我们发表的一系列论文已经证明作为HIV蛋白酶抑制剂的利托那韦有很大潜力开发成为无定型固体分散体制剂。[32,55,56]。利托那韦是一种分子量较大(721 g/mol)的亲脂性化合物。pH 6.8中几乎不溶(0.001 mg/ml),0.1N盐酸中溶解度为0.4mg/ml,固有溶出速率(intrinsic dissolution rate ,IDR)为0.03 mg/cm2 ·min。由于高给药剂量(1.2g/天),可以预见会出现溶出限制吸收的情况,随后的体内研究也证实了这种情况。在pH1的介质中,该化合物无定型的表观溶解度和固有溶出速率10倍与其相应的晶型态。
此外由于较低的流动性和巨大的构型熵,利托那韦是一种极佳的玻璃形成体(glass former)。这些性质对于无定型制剂的工艺处理、生产放大及长期稳定性是极其重要的。采用无定型利托那韦溶通过剂蒸发法制备了其固体分散体。在正常温湿度下,这些固体分散体可保持至少两年的物理稳定性。在犬类实验中,与晶型药物相比,10%的无定型固体分散体的AUC 和Cmax分别提高了22倍和14倍。
被动引入的亚稳晶型则可能导致研发窘境。有许多工艺引发的相变影响药物疗效的例子[57-59]。本文仅讨论ABT-232[60]和对乙酰水杨酸两个实例[61-64]。与利托那韦相反,ABT-232是一种亲水性高溶解度低剂量的小分子化合物。已经分离和表征的固相形态包括:1)熔点189℃的无水物;2)一水合物,90℃左右会失水并迅速结晶为无水物;3)玻璃化转变温度62℃的无定型。通过湿法工艺制备了载药0.25%-1.0% ABT-232的速释模型片。虽然API稳定且不存在辅料相容性问题,但在6个月的加速条实验中,出现药物效能逐渐下降的现象,载药越低趋势越明显(表格3)。
随后的研究发现在湿法制粒过程中会发生无水物向一水合物的转变。在随后的干燥过程以及辅料的作用下一水合物再次转变为无定型化合物。虽然API的无定型态极易向无水物转变但辅料的存在会阻碍这一趋势,导致片剂中有较高比例无定型态的存在。这正是导致湿法工艺的制剂不稳定而直压工艺的制剂稳定的原因。
表格3 ABT-232(200mg)速释片剂加速稳定性结果
众所周知水杨酸易于水解。有报道指出采用辊压后的水杨酸制备的制剂吸收水分增加导致水解加剧[61]。水分吸收增加是因为水杨酸在辊压过程中约10%左右水杨酸转变为无定型导致的。
ABT-232和水杨酸的例子都说明对固体形态和生产工艺对相变影响的表征对产品质量的保证非常重要。
在对存在多晶型的API进行处理时,特定的单元操作可能导致相变。在口服固体制剂常规的单元操作中,湿法制粒工艺是最有可能通过溶液或溶液介导机制引起相变的。当室温条件下水合物为稳定晶型但采用无水物进行制粒是经常发生相变的情况。在这种情况下在制粒过程中可能发生溶液介导的相变。随后根据干燥速度和条件的不同,最终的相态可能为最初的无水物、无定型或亚稳态水合物。本小节会讨论一系列在制粒过程中因溶液或溶液介导机制的相变。
第一个例子是盐酸硫胺,也就是已知有几种晶型的维生素B1[65]。其极易溶于水(约1g/ml),常规用量1.5-4.5mg/天。考虑到低载药制剂可能出现的含量不均匀问题及维生素B1自身的高溶解性,可能会考虑将其溶解在制粒液中进行制粒[66]。结果却证明,晶型药物溶解在制粒液中进行制粒存在许多问题。在该喷雾制粒的案例中工艺过程和储存过程均存在多此相变。制粒过程会首先形成一水合物,在干燥过程又会发生失水。颗粒中存在无水物,压片过程会快速吸湿形成一水合物。在密封瓶子内室温贮存4个月后,片剂中的一水合物又转变为半水合物同时伴随片剂硬度增加和崩解延缓现象。这种变化对产品性质的改变,至少从质控的角度而言是不希望发生的,最坏的结果则会导致生物不等效。因此,对于已知存在多晶型的化合物而言,当选用需要将API溶解的工艺时必须采用适当的预防措施。
抗惊厥药卡马西平存在三种晶型的无水物和一种二水合物[67],几乎不溶于水并且上市的规格高达400mg[68]。对于这种化合物而言可能会利用湿法制粒工艺提高流动性和可压性。人们可能会认为卡马西平的低溶解度会降低溶液介导机制相变的风险。然而Otsuka等证明在该化合物在湿法制粒过程却是发生了相变[68]。当采用纯化水、50%乙醇或5%HPC的乙醇溶液对一水乳糖、玉米淀粉及I晶型卡马西平混合物进行制粒时,50%乙醇制得得颗粒中含有相当比例的二水合物,相反,纯化水制得的颗粒则不含二水合物。在溶液介导的相变机制中,相变的速度与溶液相对于稳定相态的过饱和程度成正例。虽然二水合物在少量水存在下是稳定的,由于的相变的速率较慢使得其变得并不明显。由于Otsuka的研究是在100-500g水平开展的,但在更大规模上时,制粒后等待干燥的时间及干燥的时间必须小心控制以防止发生相变。
在第二篇文章中Otsuka研究了对不同晶型的选择是如何在制粒过程中影响相变的[70]。由于文献中卡马西平不同晶型的名称并不统一,在此我们首先对Otsuka的研究中所涉及的晶型明确。I晶型为无水的单斜晶体,据报道在室温下是热力学温度的。III晶型是与I晶型为互变晶体的三斜晶体。II晶型是III晶型单变的三方晶体[71]。IV晶型是二水合物。室温下无水物晶型的溶解度依次为II晶型>III晶型>I晶型。当采用无水物晶型进行湿法制粒时,II晶型、III晶型、I晶型相变为二水合物的程度依次为2.5%、35%、80%。
由于II晶型和III晶型高比例的相变,它们会消耗制粒液中大量的水分,在没有额外水分的情况下使得工艺变得不可行。在60℃下干燥后,采用I晶型制得的颗粒仍含有I晶型,采用II、III、IV晶型制得的颗粒,DSC图谱中几乎辨别不出II、III晶型。采用II晶型制备的片剂较其他晶型相比溶出明显变慢。采用II晶型向二水合物相变程度最高,但未确定何种原因导致溶出变慢。这个案例说明采用高溶解度的亚稳晶型可能导致以下问题:1)增加相变可能 2)增加工艺难度 3)溶出变慢。
第三个案例是用于治疗哮喘的茶碱,溶解度约10mg/ml,介于上述两个化合物之间,已知的两种晶型为无水物和一水合物[72]。Herman等报道了载药量和制粒液用量对湿法制粒片剂溶出影响的有关内容[73]。采用25%至60%不同比例的茶碱和MCC混合物对直压或不同加水量(25-80%,W/W)的湿法制粒工艺进行研究。60%载药量时,溶出速度与加水量成反比。作为对照组的直压片剂则在30min内完全溶出。当加水量增加至70%时溶出需长达8h。
25%载药量时溶出仍比对照组慢,但溶出行为与加水量并不相关。一水合物和无水物的情况相反。对于60%和25%载药制剂的不同行为,一个可能的解释是,在低载药时,有充足的水分使API在所有情况下(40-80%加水量)均发生溶液介导的相变。在高载药量时,相变的速度和程度则与加水量有关。如果在25%载药量下考察更低的加水量可能会出现类似情况(溶出与加水量成反比)。
实验室水平的研究表明聚合物和表面活性剂这类辅料会影响溶液介导相变的速度[74-77]。因此辅料也可能会影响湿法制粒中的相变。Airaksinen等采用茶碱和α-一水乳糖或茶碱和硅化微晶纤维素(SMCC)在50%载药下,采用不同加水量(3-20%)制粒,随后放在PE袋内5℃过夜放置[78]。然后对物料中的茶碱一水合物进行分析。在茶碱无水物和α-一水乳糖组中,所有加水量下均有茶碱一水物出现。在SMCC组中3%加水量下未发现茶碱一水物。
虽然加水量、暴露时间及温度等和真实制粒的情况均有一定差异,但该实验确实说明了辅料可能会影响工艺引发的相变。但原因可能是比较复杂的。例如Zhu等报道称,茶碱无水物向一水物的相变主要受水活度的驱动。但具体的动力学可能更为复杂,因为茶碱的相变在异丙醇和水的体系中比甲醇和水的体系要慢,虽然在两体系中溶解度和水的活度相同[79]。
如第一部分所述,不同相态在脆度、可压性及形变等机械性质方面会有差异。因此,工艺引起的相变会影响制剂工艺的放大和可生产性。对乙酰氨基酚存在三种晶型:稳定的单斜晶体(I晶型)、亚稳的斜方晶体(II晶型)及亚稳的III晶型。由于乙酰氨基酚可压性差,许多研究者采用其作为模型化合物对制剂的可成片性进行评价[80-82]。在片剂中I晶型与明胶、PVP或淀粉等粘合剂混合提高其可压性。许多研究者采用过多种技术手段提高乙酰氨基酚的成片性,如改变粒径及转晶等。这些研究说明固相形态对可生产性的重要性。
一般采用稳定且具有明确晶癖的固相形态对化合物进行开发是比较可行的。但这种相态可能不具有生产所需的性质。以对乙酰氨基酚为例,对其二恶烷溶剂化物进行去溶剂化后[83-85],固相迅速结晶为没有明确晶癖的晶体,文章的作者称之为融合的或多孔的晶体。热学和光谱学分析均确证该相态为I晶型,但具有新的晶癖。研究者发现,压片时作用力在含有对乙酰氨基酚融合晶体的粉体床上的传播是理想的,其较好的内聚力甚至使得直接压片成为可能。特定的生产工艺如粉碎等,可导致二恶烷溶剂化物去溶剂化,可能可以用来生产供直压工艺用的对乙酰氨基酚。
压片过程,伴随平面位移的塑性流动已被用来解释压缩的机制[86]。在对乙酰氨基酚案例中,未发生相变,因此乙酰氨基酚的II晶型被认为可用于直压工艺。工艺诱导相II晶型被报道具有较高的内聚力[87]从而成片性较好。该案例中由于压制过程变产生亚稳态晶型可被用来提高固相的可压性。
有着最高自由能或最低稳定性的是无定型。无定型通过塑性形变流动和变形,因此被认为其可压性得到改善。晶型和无定型的机械性能通过Hiestand’s指数进行了系统评价[90]。无定型在压制时表现出更脆更硬的特性,两者弹黏性比较接近。由于使用的模型药物玻璃化转变温度超过100℃,因此室温下,晶型和无定型均表现出脆性机制主导的压缩。在接近或高于Tg时,塑性形变会占主导地位。一般而言无定型表现出更好的流动性,只需较小的压力即可压制出理想孔隙率的片剂。在工艺过程中经常会发生溶液诱导的相变,并且会产生无定型,这种固相的可压性由进而影响可生产性。从另一方面而言,如果无定型的机械性质如果优于相应的晶型态,那么溶液诱导的相变可被用来提高可生产性。
固体口服制剂的品质和疗效取决于API的固相形式、剂型及生产过程等。生产工艺和产品质量之间一个重要的方面就是在生产过程工艺可能会诱导API发生相变。因此处方工艺的合理设计需要综合晶体学、晶体转变机制及工艺选择等多方面的知识。为确保产品质量一致性,在工艺设计和开发过程中必须能够做到预测、控制和防止相变。
撰稿人 | 网络
责任编辑 | 胡静
审核人 | 何发

















评论
加载更多