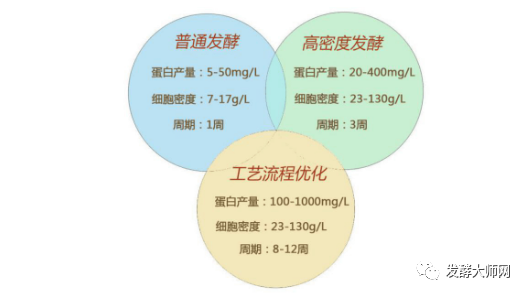
发酵工艺:蛋白类制品的大规模发酵制备及其一般纯化工艺
2.2 间接反馈控制
2.3 直接反馈控制
控制底物浓度—补料由发酵过程中碳源的浓度决定。(例如在发酵罐有实时的葡萄糖分析仪监测)大肠杆菌菌株高密度发酵研究,通过在600nm处测得细胞的OD值。
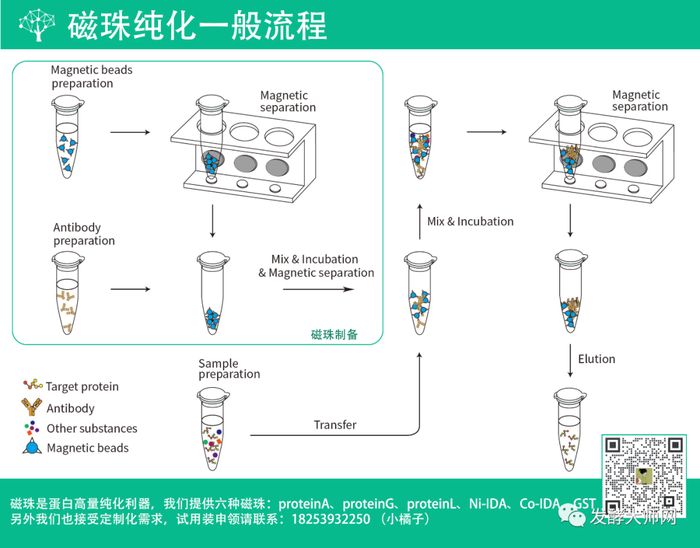
蛋白纯化策略侧重于在提高蛋白纯度的同时减少蛋白表达量的损失。因此我们常采用多种纯化方式混合纯化的方法,常用的纯化方法有以下四种:
3.1 亲和纯化
利用目的蛋白与其特异性配体之间的亲和力分离蛋白;固定化金属离子亲合层析(Immobilized metal ion affinity chromatography, IMAC),简称金属螯合亲合层析,是一种新型的应用于原核蛋白纯化的技术。该方法通过蛋白质表面的一些特殊的氨基酸,使之与金属离子发生相互作用,从而对蛋白质进行亲和纯化。这些作用包括配价键结合、静电吸附、共价键结合等,其中以6个组氨酸残基组合的融合标签(His-Tag)在原核蛋白表达中的应用最为显著。
3.2 离子交换色谱法
将离子交换剂与目的蛋白的电荷结合,通过改变PH或增加离子强度的缓冲液洗脱目的蛋白;离子交换色谱是蛋白纯化技术中常用的一种纯化方法,其原理是指被分离物质所带的电荷可与离子交换剂所带的相反电荷结合,这种带电分子与固定相之间的结合作用是可逆的,在改变pH或者用逐渐增加离子强度的缓冲液洗脱时,离子交换剂上结合的物质可与洗脱液中的离子发生交换而被洗脱到溶液中。由于不同物质的电荷不同,其与离子交换剂的结合能力也不同,所以被洗脱到溶液中的顺序也不同,从而被分离出来。
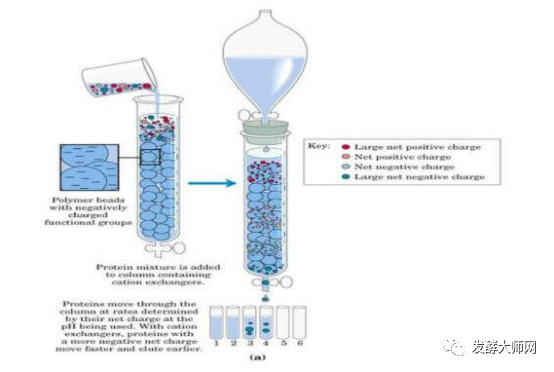
离子交换剂是由不溶于水的网状结构高分子聚合物骨架构成,骨架上有许多共价结合的带电基团,如果侧链是带正电基团,就可与带负离子相结合,称为阴离子交换剂,吸附带负电蛋白质。如果侧链是带负电的基团,则称为阳离子交换剂。强离子交换树脂在宽pH范围内保持离子化,而弱离子交换树脂只在窄pH值内离子化。
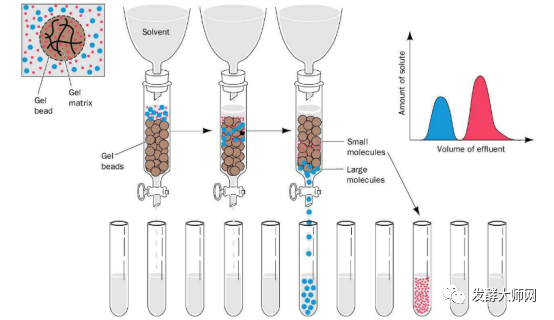
3.3 凝胶过滤色谱法
3.4 疏水色谱法
疏水色谱法是采用具有适度疏水性的填料,以含盐水溶液作流动相,借助于溶质与固定相间的疏水相互作用实现分离纯化的方法。
3.5 高效液相色谱法


此外高效液相色谱还有色谱柱可反复使用、样品不被破坏、易回收等优点;高效液相色谱的缺点是有“柱外效应”。在从进样到检测器之间,除了柱子以外的任何死空间(进样器、柱接头、连接管和检测池等)中,如果流动相的流型有变化,被分离物质的任何扩散和滞留都会显著地导致色谱峰的加宽,柱效率降低。
内容来源:发酵大师网
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多