《中国药典》药用辅料细菌内毒素标准设定的思考
目的:探讨我国药用辅料细菌内毒素质量控制和标准研究的指导原则及《中国药典》标准收载格式。
方法:通过调研我国现行药用辅料细菌内毒素质量控制相关标准,结合国际相关进展等,分析存在问题,提出适合我国国情的药用辅料细菌内毒素质量控制和标准研究的指导原则、标准收载格式。
结果:本研究结合药用辅料的特点和使用途径,对药用辅料细菌内毒素标准设定、限值计算、生产过程中药用辅料细菌内毒素控制策略等进行探讨,同时给出《中国药典》药用辅料细菌内毒素标准收载格式建议。
结论:提出了药用辅料细菌内毒素质量控制和标准研究的指导性意见和规范性要求,有助于在我国药品与药用原辅料和包装材料关联审批的制度下,完善药用辅料质量标准体系,确保制剂安全。
药用辅料系指生产药品和调配处方时使用的赋形剂和附加剂。是除活性成分或前体以外,在安全性方面已进行合理的评估,一般包含在药物制剂中的物质
[1]
。
药品的细菌内毒素检查是确保药品安全的重要检查项目,细菌内毒素不符合规定的药品在临床应用时可能产生热原反应而造成严重的不良反应。对药用辅料进行细菌内毒素控制的目的是为了保障药品制剂中所含致热物质符合规定。来源于革兰阴性细菌细胞壁的细菌内毒素是药品中最主要的致热物质,即便是细菌已经死亡,细菌内毒素可能在细胞壁碎片中保持活性
[2-3]
。由于细菌内毒素性质稳定
[4]
,在生产工艺中很难清除。因此,确保药品细菌内毒素符合规定最有效的手段就是源头控制各种原辅料、包材等细菌内毒素污染在可以接受的范围内。
基于风险管理的理念,根据药品安全性的需求,应科学、合理地在药用辅料标准中设立细菌内毒素检查项及限度。本研究对现有药用辅料细菌内毒素控制和标准制定存在的问题进行了分析,对药用辅料细菌内毒素标准设定、限值计算、生产过程中药用辅料细菌内毒素控制策略等进行了探讨,并对如何收载药用辅料细菌内毒素检查项提出了建议。本研究提出了药用辅料细菌内毒素质量控制和标准研究的指导性意见和规范性要求,对原料药、药用辅料的细菌内毒素和热原控制均有参考意义和实际应用价值。希望能为我国原辅包与制剂关联审评审批制度下,进一步完善药用辅料标准体系提供帮助。
2020年版《中国药典》通则0251《药用辅料》中规定用于静脉用注射剂、冲洗剂等的药用辅料按细菌内毒素检查法或热原检查法检查应符合规定
[1]
,在通则0102《注射剂》和0128《冲洗剂》中将细菌内毒素或热原列为一般应检查的项目
[1]
,由此可见用于静脉用注射剂、冲洗剂等的药用辅料的细菌内毒素控制的重要性。
2020年版《中国药典》通则1143 和1142 收载了细菌内毒素检查法和热原检查法,对检验方法提出了具体要求
[1]
。指导原则9251《细菌内毒素检查法应用指导原则》,对于细菌内毒素限值设定、检查方法选择、样品处理等进行了进一步说
明
[1]
。指导原则9301《注射剂安全性检查法应用指导原则》中,对于细菌内毒素、热原检查项目的设定提供了一般参考要求,并特别指出“注射剂用辅料使用面广、用量大、来源复杂,与药品的安全性直接相关。在其质量控制中,应根据药用辅料的来源、性质、用途、用法用量,配合理化分析方法,设立必要的安全性检查项目”
[1]
。
上述标准中,除注射剂安全性检查法应用指导原则对于注射剂用辅料提出了设立必要的安全性检查项目的原则要求,均未对药用辅料内毒素、热原控制提出具体可操作性的指导要求。
目前,药用辅料标准大致有以下形式: 《中国药典》收载的药用辅料标准(亦称品种正文) 、国家药品监管部门在实行原辅包与制剂关联审评审批前批准的药用辅料的注册标准、药用辅料生产企业在生产药用辅料时的内控标准、药品生产企业为某药用辅料建立的内控标准、在原辅包登记平台备案的标准等。
2020年版《中国药典》有25个药用辅料在品种标准中收载了供注射用药用辅料的细菌内毒素检查项,其内毒素限值最小为0. 002 U·mg-1,最高为0. 9 U·mg-1,具体品种和限度见表1。这些限度的设定参考了国外药典、注册标准和部分收集到的企业内控标准等,在实际应用中未必能符合各种制剂生产的需要。
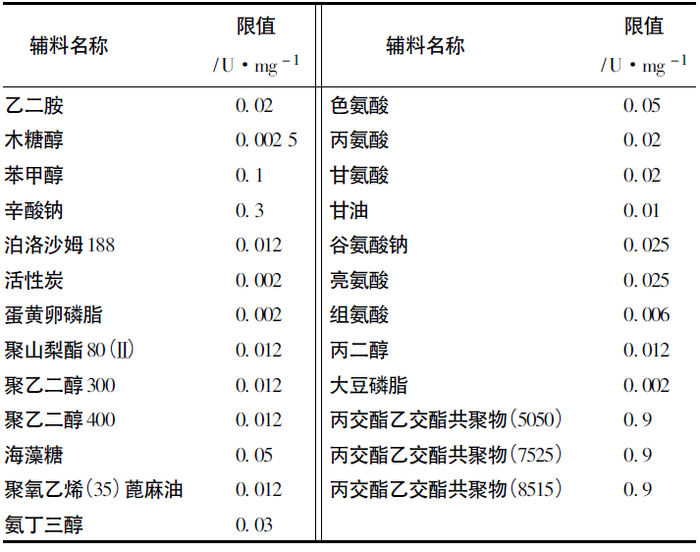
表1 2020 年版《中国药典》药用辅料细菌内毒素检查项收载情况
由于药用辅料在制剂中用途广泛,用量也千差万别,这就给药用辅料是否需要制定细菌内毒素检查项、如何确定细菌内毒素检查限值等带来很大的挑战。存在的问题: 一是在原辅料与制剂关联审评审批的政策下,如何更有效的通过控制原辅料的细菌内毒素,以确保制剂最终符合规定。二是药品生产企业如何针对制剂的需求,正确制定某一药用辅料细菌内毒素限值,应考虑哪些因素。三是作为通用的基础性标准的《中国药典》,药用辅料细菌内毒素限值一直以单一固定值的方式出现,能否满足不同制剂的不同需求,可能存在单一固定限值过严或者过松的问题。
一些国际药品标准中,已经采用了基于风险评估原则的原辅料细菌内毒素污染控制理念。《美国药典》收载了细菌内毒素检查法指导原则,认为控制原辅料细菌内毒素污染水平可以最大限度的降低制剂的风险。对于原辅料的细菌内毒素限值计算提出了要求。明确非药典材料或物品在内部检测和放行时,应在彻底了解其对制剂的潜在贡献后分配内毒素限量。从计算出的制剂的内毒素量往回推算,可以为配方中的每一种成分分配限度,并保证如果每种成分达到其限度,不会超过制剂的限度[5]。
对药用辅料进行细菌内毒素(或热原) 检查,目的是为了保证药品的细菌内毒素(或热原) 检查符合规定。一般情况下,静脉用注射剂,椎管内、腹腔、眼内等特殊途径的注射剂、冲洗液等所用药用辅料,以及用于其他对细菌内毒素(热原) 有控制要求的药品制剂生产的药用辅料,应考虑在药用辅料标准中制定细菌内毒素(或热原) 检查项。
药用辅料标准是否设立细菌内毒素(或热原)检查项,应基于风险管理的理念,采用“具体问题具体分析”的原则,根据药用辅料的来源、性质、用途、用法用量等,并结合药品生产工艺确定。
药用辅料一般首选细菌内毒素检查法,部分中药来源、多组分生化物质、生物技术来源的药用辅料,或不能排除样品对细菌内毒素检查法干扰作用的药用辅料,可选择热原检查法。
无论《中国药典》的药用辅料标准中是否收载细菌内毒素(或热原) 检查项,药品研究者及上市许可持有人均应在药品研究和生产中选用能满足药品安全性和有效性的药用辅料,并建立必要的内控标准。
基于制剂需求的药用辅料细菌内毒素检查限度设定的思路
药用辅料细菌内毒素限值制定时,应确保制剂中来源于原料、各种药用辅料及药包材、生产工艺过程中引入的内毒素总量符合细菌内毒素检查法(通则1143) 的要求。必要时不同辅料可以按照制剂配方比例混合后检测。药用辅料用于制剂生产过程中需要进行特殊处理的,应确保处理后的辅料细菌内毒素污染符合制剂生产要求。
药用辅料的细菌内毒素限值(L) 可参照公式1确定。
公式中L为药用辅料的细菌内毒素限值,一般以U·mL-1、U·mg-1等表示; R为药品制剂生产过程中允许来源于该药用辅料的细菌内毒素占制剂的细菌内毒素允许总量的比例,可参考该药用辅料在药品制剂中的占比,并考虑药品原料及其他辅料内毒素控制情况,适当从严制定。生产过程中药用辅料的允许内毒素污染量可以根据产品处方工艺、辅料特点等反向指定,并保证每种成分来源的内毒素总量不会超过制剂的内毒素限度; K取值同通则1143(细菌内毒素检查法) ; M为折合为人每千克体重每小时最大药品剂量(简称每剂药品) 中对应的药用辅料用量。
同一药用辅料在不同药品中的用途、用量差异可能较大,因此同一药用辅料应用于不同的药品制剂生产时,其内控标准中的细菌内毒素限值可能是不同的。
如经过验证,药品制剂生产工艺过程可去除细菌内毒素的,可根据细菌内毒素清除情况,放宽药用辅料内控标准中细菌内毒素检查的限值或者不设定细菌内毒素检查项。
通过一个实例,解释药用辅料细菌内毒素限值制定的公式,并说明药品生产企业在实际生产过程中如何控制药用辅料的细菌内毒素。
公式1中R值就是允许该部分药用辅料中的内毒素污染上限占制剂的内毒素污染上限的比例。也就是该部分药用辅料可以分配的内毒素污染限额。R值可以参考不同组分在制剂中的质量占比,但这只是其中的一个考虑因素。
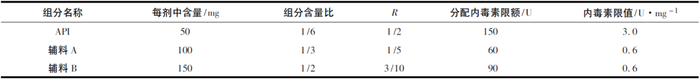
例如: 某静脉注射途径的药品S的60kg成人每1h最大用量为50mg,制剂规格为50 mg,产品总质量为300mg,其中原料药(API)含量为50mg,辅料A为100mg,辅料B为150mg。
根据细菌内毒素限值的制定要求,60kg人静脉给药时单次耐受的最大内毒素量为300U,因此规格为50mg的制剂内毒素限度为300U。制剂内毒素标准为: 取本品,依法检查,每1mg S中含内毒素的量应小于6.0U。
如果不考虑药用辅料和生产工艺等因素,原料药的标准也会定为6.0 EU·mg-1,这样,所有药用辅料等将无法制定内毒素标准。引入R的概念,就是将产品中内毒素限额合理的分配到制剂的各组分中。假设原料药和药用辅料是同等重要的,在不考虑工艺、包材污染等情况下,就是按质量占比分配内毒素限额(表2) 。

由表2可以看出,计算出来的限度,API与不同的药用辅料均相同,各种组分内毒素污染的最大限度和可以保证产品符合规定。
实际工作中确定R值,不同组分的质量比仅是参考,API或者不同的药用辅料对于内毒素污染的贡献可以是不同的。一般认为API是产品中最重要的组分,因此,R的分配可以多于质量比。各种药用辅料也可以根据用量、内毒素控制的难易程度等合理分配R值。如上例中,如果指定API的R为1/2,则API内毒素限值可以是3. 0 U·mg-1。那么辅料A和辅料B的R值和为1 /2,按质量比计算分别为1 /5和3 /10,计算二者内毒素限值均为0. 6 U·mg-1(表3) 。如实际工作中,辅料A内毒素无法控制到0. 6 U·mg-1,只能控制到1. 0 U·mg-1,那么可以调整辅料B的限值为0.33
U·mg
-
1
。此时,相当于指定API、辅料A、辅料B的R值分别为1 /2、1 /3、1 /6(表4) 。

对于一些用量较小或者很难单独进行细菌内毒素检测的药用辅料,可以考虑将不同辅料按照配方的比例混合后进行检测。如表3中情况,可以将辅料A和辅料B按2∶3的比例混合后,对混合物进行检测,限度为0. 6 U·mg-1。
实际生产过程中,细菌内毒素限额的分配,除了参考不同组分的细菌内毒素限值外,内毒素实际污染情况也是重要的参考依据。例如,某液体制剂中主要成分实际为注射用水,其内毒素限度为0. 25 U·mL-1[6],但实际检测内毒素含量为0. 01 U·mL-1。如每剂产品中注射用水的用量是250 mL,内毒素分配限额除了可以参考按标准限值计算的125 U外,也可以参考实测值2. 5 U 进行。但此时一定要基于风险的原则,从严考虑。考虑到内毒素检测方法本身的误差范围,至少应采用实测值的2~4倍扣除。由于历史原因,许多原料药设定细菌内毒素限值时,并没有考虑药用辅料、包材等的使用情况,这种情况下,实际生产时也可以参考原料药中内毒素污染的实际情况进行控制。
《美国药典》的国家处方集部分500 余个药用辅料标准中仅有17 个收载了细菌内毒素相关要求,可见《美国药典》对于药用辅料细菌内毒素项目设定的基本思路为药用辅料以满足制剂生产需要为准。具体分为以下几种情况。
蔗糖( 用于制备大容量注射液时) 限值为0. 25 U·mg-1[7]; 蛋黄卵磷脂限值为6 U·g-1[8]; 二甲硅油( 用于注射用物品接触的涂层) 限值为10 U·mL-1[9]; 重组人白蛋白限值为0. 5 U·mL-1[10]。
较为特殊的是山梨醇[11],在标准制定时考虑了药用辅料的含量: 当注射剂中山梨醇浓度小于100 g·L-1时,限值为46 U·g-1 ; 当注射剂中山梨醇浓度大于等于100 g·L-1时,限值为2. 56 U·g-1。
这些品种基本采取了相同的体例,标准正文中进行了细菌内毒素要求,但不确定限值,而是规定应符合制剂生产的需要,同时要结合标示项的描述。如辛酸[12],细菌内毒素: 细菌内毒素含量应符合使用辛酸的相关剂型各论的要求。如果标示中注明在制备注射剂过程中辛酸须经过进一步处理,则(处理后) 细菌内毒素的含量应符合各论的要求。标示:当辛酸用于注射剂生产时应在标示中注明。
3.1.3 1个品种仅在标示项中提到相关要求[13]
马来酸标示项中规定,当马来酸用于注射剂的生产时,应在标示中注明。在注射剂生产过程中,如马来酸必须经过进一步的处理,以确保细菌内毒素的可接受水平,应在标示中注明。
如二甲硅油和壳聚糖[14-15]。其中壳聚糖进行内毒素检查时供试品处理方式为: 取0. 5 g 壳聚糖置50 mL 量瓶中,加入细菌内毒素检查用水和4. 6 mL1 当量浓度盐酸,用细菌内毒素检查用水定容,混匀。在40 ℃水浴中孵育48 h 后作为储备液。试验时用细菌内毒素检查用水稀释50倍后检查( 包括用β-葡聚糖阻断剂稀释2倍) 。
《欧洲药典》在编写体例指导原则中,对于在特定条件下需要进行细菌内毒素检查的品种给出了体例要求。并且要求可在标示项中注明用于注射剂生产,以及细菌内毒素限值。其基本表达方式如下[16-17]。
细菌内毒素: 如用于注射剂生产,且没有进一步去除内毒素过程的,应小于2 U·mg-1。例2,细菌内毒素: 如果用于注射剂生产,且没有进一步去除内毒素过程的,如制剂中本品含量小于100 g·L-1时,应小于4 U·g-1; 如制剂中本品含量大于等于100 g·L-1时,应小于2. 54 U·g-1。
《中国药典》药用辅料标准中细菌内毒素收载格式的建议
鉴于《中国药典》中收载的药用辅料标准是对该药用辅料质量控制的基本标准,即便某些药用辅料会用于需控制细菌内毒素的制剂,直接在《中国药典》中对其设定单一固定的细菌内毒素限值并不能充分体现严谨性。借鉴国外药典的制定方式,按照《中国药典》药用辅料标准的体例格式要求[18],建议药用辅料标准的细菌内毒素检查项采用如下原则和方式体现。
对于有安全性控制需要、在制剂中用法用量比较明确且拟定的限度普遍认可的药用辅料,在《中国药典》相应药用辅料标准中收载细菌内毒素检查项及限值(例1) 。某些药用辅料的细菌内毒素检查操作较为复杂或特殊,可在检查项中详述具体方法(例2)。
例1: 细菌内毒素(供注射用) 取本品,依法检查(通则1143) ,每1 mg 样品中含内毒素的量应小于0. 012 U。
例2: 细菌内毒素( 供注射用) 取本品,先加1%无内毒素的碳酸钠溶液将供试品溶解并稀释制成每1 mL 中含80 mg 的溶液,再用内毒素检查用水稀释至所需浓度,依法检查(通则1143) ,每1 mg 样品中含内毒素的量应小于0. 10 U。
对于明确需要进行细菌内毒素控制,但限值不宜统一要求的药用辅料,在《中国药典》相应药用辅料标准中将细菌内毒素作为检查项收载,在标示项以U为单位标明每1 mL(mg等) 本品中含细菌内毒素的限值或含量(例3) 。某些药用辅料的细菌内毒素检查操作较为复杂或特殊,可在检查项中详述具体方法(例4) 。药品生产企业按照制剂生产需求制定内控标准。
例 3: 细菌内毒素(供注射用) 取本品,依法检查(通则1143) ,每1 mg 样品中含内毒素的量应小于标示值。
[标示]应标明每1 mg 样品中含内毒素的量应小于的标示值或每1 mg 样品中含内毒素的量。
例4: 细菌内毒素(供注射用) 取本品,先加1%无内毒素的碳酸钠溶液将供试品溶解并稀释制成每1 mL 中含80 mg 的溶液,再用内毒素检查用水稀释至所需浓度,依法检查(通则1143) ,每1 mg 样品中含内毒素的量应小于标示值。
[标示]应标明每1 mg 样品中含内毒素的量应小于的标示值或每1 mg 样品中含内毒素的量。
《中国药典》通则0251药用辅料中规定“标示项下规定应标明的内容应在产品标签、包装、质量标准或检验报告书( 其中至少一个) 中标明”,以便药用辅料的生产环节和使用环节( 药品生产企业) 可以进行约定与查验,第三方( 如监管部门) 也可以进行必要的抽查检验。
随着原辅包与制剂关联审评审批政策在我国的实施,如何科学合理地制定原料药、药用辅料、包材等质量标准,还存在一些亟需解决的问题[19-22]。国家药典委也在积极推动标准研究适应关联审评等新要求,致力于建立既符合药品质量控制的基本要求,又能切实有效指导生产实际的标准研究规则和体系。
本研究从药用辅料细菌内毒素控制的角度进行了探讨,采用了以满足制剂需求为核心的辅料质量控制理念,这也是被欧美等先进国家所接受的。但标准变化在一定时间内也会给行业带来一定的挑战,如辅料生产企业如何能生产出满足不同制剂生产需求的辅料产品,药品监管部门如何加强辅料生产的监督管理等。这有待于监管部门与相关企业等共同努力,推动原料药、药用辅料和药品标准的研究更加规范、有效,促进药品生产企业落实主体责任,确保人民群众用药安全。
致谢: 高华研究员、唐黎明主任药师、袁耀佐主任药师等专家指导和帮助; IPEC 中国、北京药检院、天津药检院、湖州展望药业、齐鲁制药等单位提供建议。
[1] Ch. P( 2020) Vol Ⅳ( 中国药典2020 年版. 四部) [S].2020:3-5,25, 32-33, 178,178-181, 515-520.
[2] BEVERIDGE T J. Structures of gram-negative cell walls and their derived membrane vesicles[J]. J Bacteriol,1999,181 ( 16) :4725-4733.
[3] KULP A,KUEHN M J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles[J]. Annu Rev Microbiol,
[4] ZHANG J L,HE W. CMC requirements for injections in consistency evaluation of generic drugs[J]. Chin New Drugs J( 中国新药杂志),2019, 28( 14) : 1688-1692.
[5] U. S. Pharmacopeial Convention,USP-NF [S].GUIDELINES ON THE ENDOTOXINS TEST,2020. [2022-04-08]. https: / /online. uspnf. com/uspnf /document /1 _ GUID-CC17E1DF-5576-4A86-90EF-78ED081ECB76 _ 3 _ en-US? source = Search%20Results&highlight = GUIDELINES% 20ON% 20THE%20ENDOTOXINS%20TEST.
[6] Ch. P( 2020) Vol Ⅱ( 中国药典2020 年版. 二部) [S].2020:857.
[7] U. S. Pharmacopeial Convention,USP-NF[S].Sucrose,2021,[2022-04-08]. https: / /online. uspnf. com/uspnf /document/1_GUID-3082C3E4-FC9B-4A62-B8DB-0CC5AA52E184_5_en-US? source = Search%20Results&highlight=sucrose.
[8] U. S. Pharmacopeial Convention,USP-NF [S]. Egg Phospholipids2018,[2022-04-08]. https: / /online. uspnf. com/uspnf/document/1_GUID-1DDB7C4A-3C67-4930-A94D-36D3E9E7F88B_3_enUS?source = Search%20Results&highlight = Egg%20Phospholipids.
[9] U. S. Pharmacopeial Convention,USP-NF [S].Dimethicone,2020, [2022-04-08]. https: / /online. uspnf. com/uspnf/document/1_GUID-9FD84A28-34BB-48B2-A2DA-21A66F41033A_3_en-US? source = Search%20Results&highlight=Dimethicone.
[10] U. S. Pharmacopeial Convention,USP-NF [S].rAlbumin Human,2018, [2022-04-08]. https: / /online. uspnf. com/uspnf /document /1_GUID-41502DA6-F588-4F2F-86DF-87C887AAE874_3_ en-US? source = Search% 20Results&highlight = rAlbumin%20Human.
[11] U. S. Pharmacopeial Convention,USP-NF[S].Sorbitol,2021,[2022-04-08]. https: / /online. uspnf. com/uspnf /document/1 _GUID-3C295111-A9C0-4784-97BD-C3D66B95E155 _4 _ en-US?source = Search%20Results&highlight = Sorbitol.
[12] U. S. Pharmacopeial Convention,USP-NF [S].Caprylic Acid,2020, [2022-04-08]. https: / /online. uspnf. com/uspnf/document/1 _GUID-D476FF8A-3D4A-4039-8929-76F8B43E6EB3 _5 _en-US? source = Search% 20Results&highlight = Caprylic%20Acid.
[13] U. S. Pharmacopeial Convention,USP-NF[S]. Maleic20Acid,2020,[2022-04-08]. https: / /online. uspnf. com/uspnf/document/1_GUID-77B44933-C260-4150-9E47-9510D745EBAC_5_en-US? source = Search% 20Results&highlight=Maleic%20Acid.
[14] U. S. Pharmacopeial Convention,USP-NF [S].Dimethicone,2018,[2022 -04 -08]. https: / /online. uspnf. com /uspnf /document /1 _ GUID-9 FD84A28 -34BB-48B2 -A2DA-21A66 F41033A _ 3 _ en-US? source = Search%20Results&highlight = Dimethicone.
[15] U. S. Pharmacopeial Convention,USP-NF [S].Chitosan,2020,[2022-04-08]. https: / /online. uspnf. com/uspnf /document/1 _GUID-30832BBE-AFC1-463B-9695-AB4EF0A14413 _ 6 _ en-US?source = Search%20Results&highlight = chitosan.
[16] EDQM. European Pharmacopoeia Style Guide [S].2022,[2023-01-22].
[17] EP 10. 0 [S]. trehalose dihydricum: 4080-4081.
[18] Chinese Pharmacopoeia Commission. Style Guide of the standards for Pharmaceutical Excipients in China ( Edition 2020) ( 国家药用辅料标准编写细则2020 年版) [S]. 2020,[2022-04-08].
[19] CHEN L,ZHANG Y Y,ZHENG A P,et al. Thoughts on the high quality development of pharmaceutical excipients industry in China[J]. Chin Pharm Aff ( 中国药事) ,2021,35 ( 9 ) : 972-977.
[20] QIAN J Y,LIU B Y,YU Z. Suggestions to Chinese manufacturers of pharmaceutical packing materials under the policy of associated evaluation[J]. Chin New Drugs J ( 中国新药杂志) ,2020,29( 9) : 972-977.
[21] CHEN L,SONG Z H,HU S J,et al. An introduction to the
standards system and main characteristics of pharmaceutical excipients in the 2020 edition of Chinese pharmacopoeia[J]. Chin Pharm J ( 中国药学杂志) ,2020,55( 14) : 1177-1183.
[22] MA J W,AN N. Consideration of excipient selection in freezedried injections[J]. Chin Pharm J ( 中国药学杂志) ,2020,55(7) : 568-572.
撰稿人 | 祝清芬,张娟,朱冉,耿雪,刘瑞,陈蕾
责任编辑 | 胡静
审核人 | 何发

















评论
加载更多