【药厂】消毒剂使用及效力验证
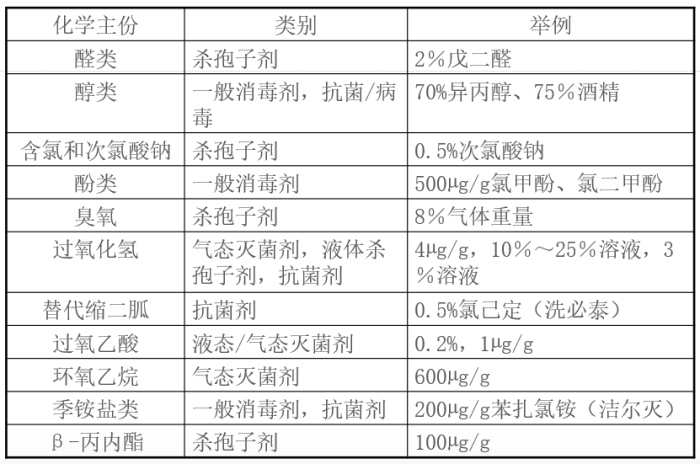
1.
消毒剂配制及其注意事项:
按供应商的使用说明进行配制和储存(纯化水、注射用水)
洁净室及相关受控环境使用,应进行除菌过滤。
温度提高,杀菌效力增大。效力验证时,在常温下配制。
2.
影响消毒剂效力的因素有:
pH;温度,浓度;材质和附着物质;溶剂(水);接触时间;微生物的类型和数量;
3.
消毒剂作用机理:
钝化胞内酶活性,影响细胞的正常代谢(如酚类)
阻断物质运输通道(如季铵盐类(+电荷),附着于细胞膜特定部分(-电荷))
破坏微生物细胞(膜)的结构和功能(如醛类、含氯、过氧化物)
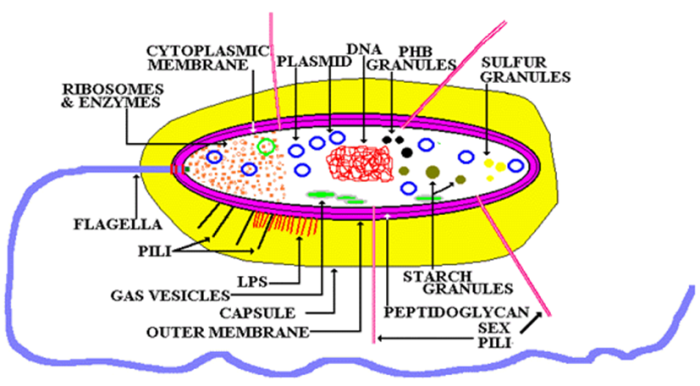
4.
微生物对消毒剂的耐受性受以下几方面因素的影响:
形成生物膜(粘性多糖物质)
消毒剂的相互作用(中和反应)
固有耐受性和概率残存
致死剂量
5.
微生物抗力由小到大排列一般为:
细菌繁殖体--真菌繁殖体--真菌孢子--病毒--分枝杆菌--细菌芽孢
6.
消毒剂的选择考虑如下因素:
需控制的微生物的类型和数量
市售消毒剂的抗菌谱
消毒剂的品牌
浓度、使用方法和接触时间
待消毒物体的材质和对消毒剂的兼容性
可能影响杀菌效力的表面有机物数量
反复使用,对设备表面的腐蚀程度
对操作者的安全性
和清洁剂/其它消毒剂的相容性
交替使用方案和对产品的影响
7.
消毒剂验证步骤:
第一步:在实验室对代表细菌在规定的使用浓度和规定的作用时间进行确认。
第二步:应用不同材质的载体,进行模拟试验
第三步:完成验证报告,形成SOP。
8.
验证用菌种:
金黄色葡萄球菌、铜绿色假单胞菌、沙门氏菌、大肠埃希菌、枯草杆菌、白色念珠菌、黑曲霉、环境分离菌。
菌种选择的原则:代表性,普遍性,标准菌种。(环境中常见的污染菌)。菌种的要求:不得超过5代。
采用适宜的方法保存。
9.
挑战微生物(USP29):
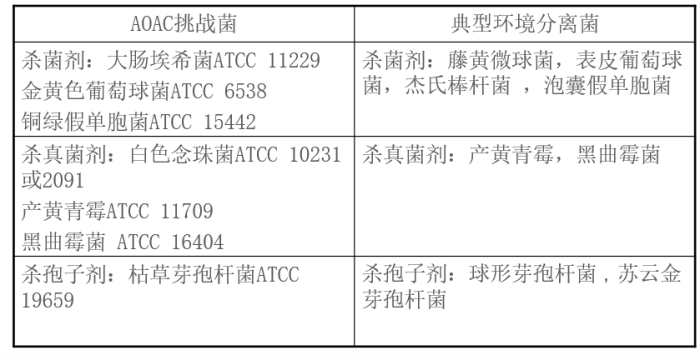
10.
准备性试验:
选择适合的中和剂:Letheen肉汤、D/E中和肉汤(酚类,季铵盐类)、TAT肉汤基础+吐温20+卵磷脂+胰蛋白胨
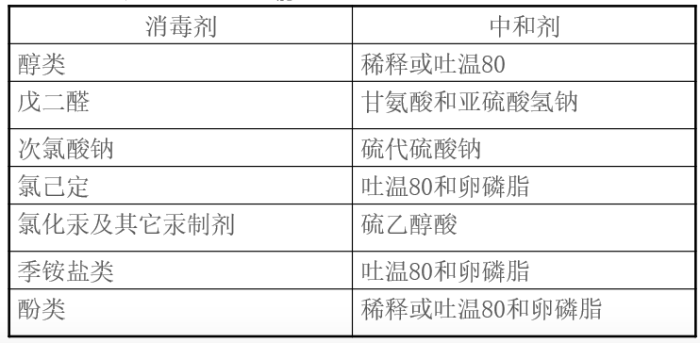
10.1
D/E中和肉汤配方(每升):
胰蛋白胨5g;酵母膏2.5g;葡萄糖10g;硫乙醇酸钠1g;硫代硫酸钠6g;亚硫酸氢钠2.5g;吐温805g;卵磷脂7g;溴甲酚紫0.02g;最终pH7.6±0.2于25℃;
10.2
准备性试验之中和剂毒性:
将10~100CFU的微生物加入到中和剂中;薄膜过滤,冲洗,培养,计数¢与菌液对照组比较,回收率应>70%
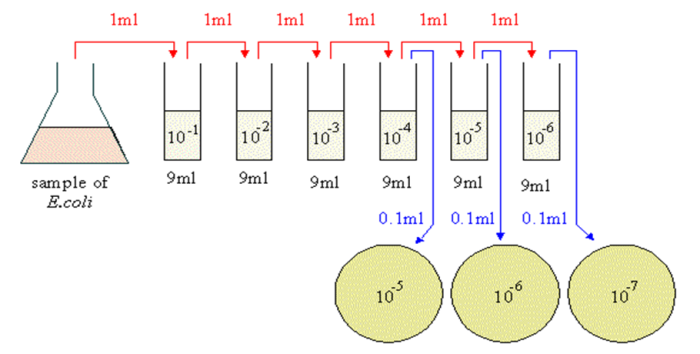
10.3
准备性试验之中和效力:
使用中稀释检测(use-dilutiontests)(对不同浓度下,对消毒剂的效力进行筛选;针对不同标准菌株和环境微生物,确认接触时间)
将消毒剂和中和剂混合(记录时间)
加入10~100CFU微生物¢薄膜过滤,冲洗,培养,计数
与菌液对照组比较,回收率应>70%验证方法
薄膜过滤法:菌悬液和消毒剂直接混合,在不同的时间间隔条件下过滤,培养后评价。
11.
验证准备:
测试菌液准备:增菌过夜,并调整至106~108CFU/ml
消毒剂稀释至规定浓度:分装10ml于若干无菌试管中;试管上标注消毒时间:如“1分钟组”,“5分钟组”,“10分钟组”或其他要求的时间段。
配制中和剂(分装100ml,300ml)验证步骤:
接种:接种各验证菌种至盛有待验证消毒剂的试管(使接后浓度>104CFU/ml),混合均匀,并立即开始计时。
中和、过滤:将消毒剂倾入100ml中和剂中,混合,稀释(如需要),过滤,然后用100ml中和剂清洗滤膜,滤过3次。
阳性对照:用无菌水代替消毒剂,步骤同上。
培养和计数:取下滤膜放入规定的培养基平板,在规定的温度、时间培养后,记数。和阳性对照相比,微生物数量下降应至少3个对数值(细菌芽孢至少2个对数值)。
表面挑战试验(surfacechallengetests)
使用标准菌株和典型环境分离微生物
选择合适的浓度和接触时间,进行试验
获得挑战微生物数量下降的对数值
对使用新消毒剂前后环境微生物的检出频率和数量进行统计学评估(无菌生产区域、GMP要求)
根据设施的实际情况,选择不同材质的载体(玻璃,不锈钢,塑料薄膜,乳胶,墙面涂料,地面材质)
接种,并确认实际数量
接触杀菌、中和、过滤。
12.
正确使用消毒剂:
① 稀释消毒剂时应用纯化水、注射用水
② 设备使用后彻底清洁
③ 将环境常见菌列入验证范畴
④ 轮换使用不同的消毒剂,消毒剂间要用无菌水充分清洗
⑤ 消毒的SOP:配制、使用、纠正、防护等
⑥ 供应商的审核和确认
13.
消毒剂的文件:
标准操作规程SOP
消毒剂配制记录
消毒剂使用记录
消毒剂标签消毒剂文件,应该等同于原始记录。
内容来源:制药工艺与装备
撰稿人 | 网络
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多