国外已上市连续制造药品的注册审评情况及其启示
美国食品药品监督管理局(Food and Drug Administration,FDA)一直致力于支持新兴制药技术的应用,其定义的新兴制药技术包含了原料药(活性成分)的连续制造、药物制剂的连续制造、基于模型的连续制造控制策略、连续的无菌喷雾干燥、生物制品的小型连续制造平台等多项连续制造技术[2]。
近年来,在FDA的持续倡导和推动下,连续制造技术在制药行业受到了极大的关注和发展,药品生产将发生从传统的批生产模式到一个前瞻性的连续生产模式转变。随着质量源于设计(QbD)理念在制药研发和生产中的深入应用及过程分析技术(Process Analysis Technique,PAT)的进步,药品连续生产具备了实现的基础[3]。
尽管如此,作为制药领域相对新兴的技术,连续生产在产品的开发、注册审批、监管审批、实施、生命周期管理等方面都面临挑战,对该技术的全球监管方面也缺乏协调一致[1]。国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)自2018年开启了连续制造指南计划,旨在推进连续制造技术在各地区的法规评价和监督一致性。我国作为ICH成员也参与了指南的起草工作,国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)已于2021年10月发布了ICH指导原则《Q13:原料药和制剂的连续制造》征求意见的通知[4],意味着连续制造指南将在征求意见后的阶段中,经讨论后采纳并落地实施。我国也随之面临ICH连续制造指南落地实施后的监管挑战。本文通过梳理全球已上市的连续制造产品的批准情况,主要是应用连续工艺比较成熟的口服固体制剂产品,对其在注册过程中的工艺评估及审评情况等特点进行概述,以期为我国药品连续制造监管法规、技术指南和标准的制定等方面提供参考。
Part
1
自2015年美国FDA首次批准连续生产工艺申请以来,连续制造在制药行业的实施频率一直在稳步上升。特别是口服固体制剂产品,已有多项使用连续生产工艺的品种申请获得批准。笔者根据近年有关报道,对国外使用连续生产工艺的口服固体制剂审批信息进行了汇总,数据显示,截至2021年底,已知的获批上市品种有9个,共有16个药品连续制造批准文号,其中有7个品种在FDA;6个品种在欧洲药品管理局(European Medicines Agency,EMA),与FDA基本同步;1个在英国药品和保健品管理局(Medicines and Healthcare Products Regulatory Agency,MHRA),2个在日本医疗品医疗器械综合机构(PDMA)。如表1所列。
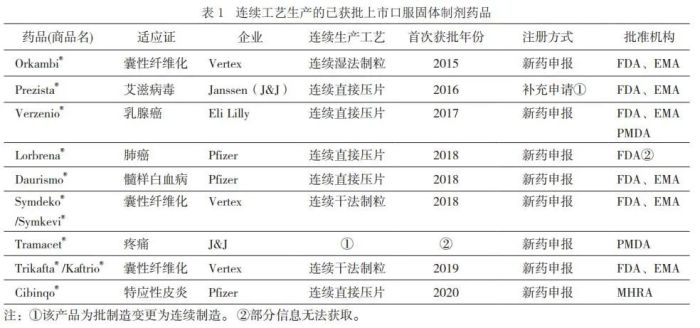
上述9个获批品种涉及4家集团公司,包括Vertex(福泰)的3个品种、Janssen(J&J强生)的2个品种、Eli Lilly(礼来)的1个品种、Pfizer(辉瑞)的3个品种;涉及3种生产工艺,包括连续湿法制粒、连续干法制粒、连续直接压片。
Part
2
1
福泰制药:Orkambi ®
福泰是第一家获得FDA连续生产产品批准的公司,产品是口服制剂Orkambi®,获批时间为2015年7月,适应证为囊性纤维化。该产品生产通过德国GEA集团开发的完全集成连续加工平台完成,其工艺特点是原料粉末通过中间容器送入系统,干法、湿法制粒和最后的包衣工序都是连续的[5]。
Orkambi®的生产工艺分为2个阶段。在第一阶段,结晶的依伐卡托原料药与聚合物、表面活性剂在溶剂中溶解,然后喷雾干燥形成粉末,经过二次干燥以进一步去除溶剂至可接受的限度,形成一种自由流动的、可压缩的粉末即喷雾干燥分散体。第二阶段,通过7个步骤完成片剂的生产,包括颗粒内混合、双螺杆湿法制粒、流化床干燥和研磨、颗粒外混合、压缩、薄膜包衣和包装。
该药品建立了3个不同的生产基地,均采用连续湿法制粒工艺,但生产系统和过程分析技术(PAT)的应用能力略有不同。其中生产基地1采用双螺杆造粒机,由间歇式混合机进料,然后独立间歇式流化床干燥。生产基地2有一条连续压片生产线,从制粒到压片以连续模式运行,预混合和薄膜包衣以间歇模式进行。生产基地3则使用一套集成系统,从单个的物料组分输入一直到生产出完整的薄膜衣片均以连续模式运行,并支持实时放行检测(Real-time Release Detection,RTRT)的功能[6]。
2
杨森制药:Prezista®
杨森制药公司是第2个获得连续生产FDA产品批准的公司,获批时间2016年4月,产品是口服制剂Prezista®,一种蛋白酶抑制剂抗病毒药。该片剂通过集成的直接压片连续加工平台生产,其工艺特点是粉末通过真空输送器被送入系统,然后进行混合、压缩和包衣,工艺连续不间断、完全自动化且全程借助PAT进行控制[5]。
Prezista®是FDA首次批准的上市后变更为连续制造类型的产品。杨森公司的申报策略考虑了多方面的原因,主要有以下3个方面,一是该产品工艺是直接压片,工艺简单;二是该产品是一个比较成熟的产品,工艺稳定;三是该品规是一种非常重要的HIV治疗药物,有相当规模的市场需求。这些经验对我国在已上市产品由批生产变更为连续生产的申报和审评审批方面提供了参考。
该品种在递交补充申请时,充分考虑了FDA的关注点,提供了相应的控制策略资料,主要包括生产线管理、设备集成、工艺控制模型和沟通交流几个方面。企业与罗格斯大学合作, 利用不同厂家的单个设备组件,从机械和电子控制方面对设备进行整合, 再对所有设备(投料机、搅拌器等)特性进行研究,理解数学模型、术语、驻留时间分布、物料的表现、不同的物料是如何从开始到结束的过程中传输的。申报资料重点证明了生产线控制水平和持续质量保证能力。FDA在前期也和企业进行了一些沟通,了解相关的计划、模型等,并将意见反馈企业,企业则根据意见及时进行了调整[7]。
3
礼来公司:Verzenio®
礼来公司的Verzenio®于2017年9月获得FDA批准。该品种为CDK4/6抑制剂,是一种口服药,其生产系统采用半集成的直接压片连续加工平台,包括高度精确的粉末进料、混合和压片。该平台设有一套独特的创新提升系统用于支持主要的工艺流程,易于清洁和更换[8] 。
工艺和设施的可复制性是该产品实现连续化生产的一个关键推动因素。2014年,礼来公司在印第安纳波利斯现有的口服固体生产设施中建设了符合GMP的连续生产线,随后于2015年在波多黎各卡罗莱纳现有的口服固体生产设施中成功复制了一套GMP连续生产线。这两条生产线都使用连续直接压片工艺,具有相同的设备、布局、过程分析技术(PAT)仪器和自动化控制方案。这种设计改善了从开发到生产的技术转移,而且提高效率降低成本,以实现快速的商业化,具有广泛的扩展能力。
4
辉瑞制药:Daurismo®、Abrocitinib
辉瑞公司的Daurismo®于2018年11月获得FDA批 准 , 该 产 品 用 于 急 性 骨 髓 性 白 血 病 ( A c u t e Myelogenous Leukemia,AML)患者治疗,获得孤儿药和优先审评资格。该产品的片芯是通过直接压片工艺制造的,使用了辉瑞公司设计的便携式、连续、微型和模块化(Portable,Continuous, Miniature and Modular,PCMM)的连续制造平台。这套连续制造平台是辉瑞公司与G-CON制造公司和德国GEA集团合作开发,其预制的自主口服固体制剂生产设施在辉瑞公司现有的仓库中完成安装。该设施的设计是为了便于拆卸和搬迁,属于模块化制药设施。2020年,辉瑞公司的另一款连续制造产品,口服Janus激酶1(JAK1)抑制剂Abrocitinib,获得英国药品和保健品管理局(MHRA)批准上市,适应证为特应性皮炎,其生产同样使用了PCMM连续制造工艺平台。
Daurismo®的连续生产工艺包括前3个步骤:连续给料、连续混合、使用传统旋转式压片机压片,最后的工序是使用常规设备作为分批过程进行的薄膜包衣过程。连续工艺生产的片芯在传统的批片包衣工艺中进行包衣的操作模式,可以看做是连续+非连续的非标准连续生产过程。
2019年,辉瑞公司又向EMA提交该产品的上市申请。按EMA的要求,资料中提供了相应的工艺风险评估,主要内容有如下几个方面[9]:
(1)质量风险评估。工艺开发重点是目标产品质量概况(Quality Target Product Profile,QTPP)中确定的产品和质量属性,以确保产品的质量、有效性、稳定性和安全性,并在产品规范中定义。基于风险的评估、结合实验室研究、计算模型和生产经验,促进对配方和工艺条件及其对这些质量属性影响的全面理解。
(2)多变量实验。为进一步了解生产工艺步骤,并评估确定的工艺参数范围对产品质量属性的影响,企业制定了一个多变量实验计划。对于连续给料工序,通过实验证明重力给料机能够以目标质量流速给料,且基于总体目标质量流速的瞬时质量流速波动较小。研究内容涵盖了原料药和赋形剂的批次,以评估材料属性变化对给料机性能的影响。每个给料机都进行连续的监测,并控制到目标质量给料速率。对于连续混合工序,进行了风险评估,以指导创建实验活动,并确定驻留时间分布(Residence Time Distribution,RTD),同时进行了3个具有代表性的阶梯变化实验,以推演整个工艺过程系统的动力学。
(3)PAT应用。该生产线使用了一个自行开发的近红外过程控制系统,该系统可对不合格材料进行监控和实时剔除。EMA的NIR(近红外光谱)的指南及其附录要求企业建立近红外光谱模型,企业考虑到有可能出现无法获得近红外光谱(例如近红外模型更新)的情况,企业建立了一项应急计划,该计划包括片芯分层取样,并通过高效液相(HPLC)参考方法进行离线检测。此外,多层控制和报警能确保检测到片芯含量的变化,不合格品将被拒收。
5
福泰制药:Symdeko®
Symdeko®是福泰公司在2018年获得FDA批准的连续生产品种,用于治疗囊性纤维化。其中50 mg/75 mg规格仍使用原有的批生产工艺进行生产,100 mg/150 mg规格则使用连续工艺进行生产,并与之前批准的Orkambi®产品在同一个连续生产平台进行生产。连续生产工艺(100 mg/150 mg规格)的生产原则与传统批次的工艺生产(50 mg/75 mg规格)原则相同,因其生产单元操作和物料都是相同的。由于依伐卡托喷雾干燥分散体(Ivacaftor SDD)的材料属性和工艺参数之间存在潜在的相互作用,因此FDA也审评了模型确认相关的研究资料,以确认结果过程模型的准确性[10]。
6
福泰制药:Trikafta®
Trikafta®是福泰公司在2019年10月获得FDA批准的又一个治疗囊性纤维化的连续生产品种。该产品在连续制造开发和发布平台(DLR)上使用连续制造工艺开发,与Orkambi®和Symkevi®类似,最初的临床供应品使用非连续工艺生产的,但非连续和连续工艺都用于关键临床试验的产品生产,且非连续和连续生产使用的都是完全相同的设备。该连续生产平台(DLR)由一个过程控制系统负责运行,该系统可以显示正在运行的单元操作、中控和关键工艺参数的状态、工艺趋势以及报警。
在连续生产过程中,使用产品密钥(Product Key)概念跟踪物料,当检测到超出可接受标准的中间过程控制结果时,具备特定PK的物料将从工艺流程中移除,方法按要求进行了验证[11]。
Part
3
1
产品研发过程关注点
在连续工艺研发过程中,应基于连续制造的技术特点开展研究,重点关注定义“批次”的方法、设备设计、控制策略、现有监管指南的应用、流程和PAT模型以及这些模型的用途、实时放行检测计划、过程验证计划等方面。
从设备设计方面看,连续生产技术的工艺特点是灵活高效,自动化程度高。这就要求在工艺开发过程中使用的工程和设备能达到相应的连续化控制水平,互相匹配,才能更好地加强连续工艺的可用性和优势,二者相辅相成。礼来、辉瑞和福泰公司的连续工艺生产平台均采用了便于复制的模块化的设计概念进行设计,相关审评审批结论认为其可用于研发和商业化生产,这也减少了企业工艺放大和技术转移的工作量。
礼来公司在产品开发和申报过程中参考了已发布的现行连续生产相关的指南草案,并向监管机构寻求连续生产工艺相关的建议,包括:商业批量的明确性、关键步骤控制的清晰度,以及是否使用PAT模型、是否使用RTRT实时放行策略等[12]。在控制策略方面,监管部门和行业应该尽早沟通,在企业决定开展连续制造工艺开发阶段,或工艺变更阶段,应主动与监管部门沟通,并邀请监管机构进行沟通;监管部门可根据需要开展实地考察,达成共识,可有助于推动项目临床和注册的加速进行。
例如:杨森公司的产品工艺由传统工艺变为连续生产工艺,以及福泰公司的产品连续生产工艺本身进行了变更,监管机构与企业均进行了密切沟通,并对问题进行了讨论和改进。监管部门除了关注连续制造工艺的一般特点外,重点关注了连续生产技术中使用的模型,会基于收集到的更多数据而进行更新,如果模型用于确定产品相关的质量属性(例如近红外相关模型),企业应进行申报。使用连续制造的工艺在注册申报通用技术文件(Common Technical Document,CTD)中与传统工艺相比有部分特定的信息需要提交,主要涉及CTD章节3.2.P和3.2.S的部分章节,包括:制造工艺的开发(包含控制策略)、批次定义、制造工艺和工艺控制的描述、关键步骤和中间体控制、质量标准/分析程序、质量标准说明等[13]。当使用工艺模型时,需要在制造工艺开发章节中提供模型的开发和论证,并在工艺控制描述章节中进行概述,同时在关键步骤和中间体控制章节中描述模型验证数据和维护方案;当使用实时放行(Real-time Release,RTRT)策略时,应在质量标准/分析程序章节中描述方法和标准;当使用PAT时,应在质量标准说明章节中描述分析控制策略概要。
2
产品注册审评关注点
从国外已上市连续制造药品的批准情况来看,FDA、EMA等欧美监管机构在目前的监管框架下,已组建了相关的新兴技术团队或创新小组[14-16],对连续生产的药品开展技术审评,为推进药品创新技术提供支持。各监管机构也着手制定相应的指导文件和程序以便对连续制造应用进行评价,例如,FDA已于2019年2月发布了关于连续制造的指南草案[17],ICH已于2021年7月完成第2阶段的ICH Q13
指南草案[13]。笔者认为,在产品注册审评方面,可考虑关注如下几个方面:
(1)批量的定义。根据现行指南和以往审评审批经验,批量可由生产时间或物料质量定义,可以是一个范围。如其他参数不变,可通过延长生产时间增加批量,并由企业内部质量体系来管理。如果以生产时间作为批次定义,需要考虑一个固定的工艺生产速率。目前的已上市的品种均以质量来定义批次,尽管如此,考虑到监管对工艺的稳健性的要求,福泰公司的Trikafta®在连续生产工艺中还是需要定义一个固定的连续生产速率。
(2)工艺验证。现行法规对连续工艺和传统工艺的工艺验证要求基本类似,对于连续工艺而言,可以充分利用之前批次的生产经验,并结合使用商业规模批次和之前的开发以及临床批次的数据支持工艺验证,并不是一定要3个连续生产的商业规模批次。监管方可以关注企业的评估研究资料的审评,评估现有的开发数据、拟定的控制策略和来自商业规模批次的批次分析数据是否完全支持拟定的设计空间。福泰公司的Symdeko®生产工艺在商业生产规模下对6批进行了验证(3批30公斤和3批40公斤),在申报过程中企业实际提供了3个40公斤批次的实际验证报告。
(3)技术转移。如果在不同场地使用了完全相同的连续生产设备,技术审评可关注技术转移方面的简化研究数据是否支持其可比性,包括对不同生产场地的连续生产设备的确认资料等。
(4)清洁验证。连续工艺的清洁验证与传统生产工艺类似,可使用相同的清洁剂、清洁步骤、分析方法和验证方案等,审评时应关注连续生产的制造设备在设计上易于清洗和更换部件方面的考虑。
(5)工艺监测和控制:PAT通常适用于连续工艺的监控,以实时监测产品质量属性,审评过程考虑关注是否设置多种控制方式和策略,是否制定相应的应急计划,例如当近红外过程控制(near infrared ray,NIR)出现故障或不可用时,能否及时使用分时取样和离线检测的方法确保产品质量。
(6)PAT的稳健性。PAT是通过即时测量原始和中间物料的质量属性和工艺条件,用于设计、分析和控制制造,以确保终产品质量的系统[18]。常用的PAT工具有在线过程光谱分析仪器,例如在线红外光谱分析系统,审评过程可关注资料中是否建立了相应的多变量模型来进行监测,研究数据是否充分并进行稳健性的验证,模型验证是否符合相关的近红外验证指南要求,例如EMA的制药行业使用近红外光谱的指南[19]以及FDA的近红外过程分析的开发工业指南[20]。近红外分析模型直接影响产品质量的检测,通常认为该模型是高风险的,需要关注企业是否能够详细描述模型的原理,并对模型的开发与验证、维护进行全生命周期的管理。
(7)物料的可追溯性和转移。通常,批生产是通过记录所使用的各物料批号来实现物料的可追溯性,但连续制造工艺审评考虑要点略有不同,需考虑可能产生不合格物料的时间段,关注是否使用时间标记来直接关联物料和成品,当物料不符合质量标准时是否对用到该物料的整批成品进行调查。例如-FDA在审评福泰公司的Trikafta®资料过程中,对物料追踪有较高的关注,认为在生产过程中使用产品密钥(Product Key)概念追踪物料、对不合格的物料和成品进行剔除是可接受的。
Part
5
从获得批准的品种大多数是小分子口服固体制剂的产品连续生产可以看出,口服固体制剂的产品开发在采用连续生产工艺方面具有一定的优势,比如:工艺简单稳定,有较为成熟的连续生产设备和在线PAT支持。连续制造的工艺研究的深度和广度决定了控制策略的复杂程度,同时也对设备的稳健性、自动化控制系统精度、控制模型的适用性提出了更高的要求。
先进新兴技术的发展将进一步推动连续制造的相关优势,也给药品监管带来挑战。通过对口服固体制剂的连续制造注册审评和工艺评估情况结合相关法规和指南开展调查研究,笔者认为我国在开展连续制造工艺产品技术审评时,首先应鼓励企业在早期连续工艺开发阶段就与监管部门加强沟通,同时监管方应关注连续制造工艺研究是否充分支持其批量定义方式;生产设备性能是否稳定,能够提供足够的可靠数据以支持研发到商业化批量生产的转移;工艺监控中使用的PAT是否能有效监测产品质量,模型是否经过验证;能否采取有效的物料标记手段对物料进行追溯,有效剔除不合格品等,对于采用实时放行策略的连续生产,应审慎评估实施放行分析控制策略的可行性和替代方案。从药品全生命周期的角度来看,注册要求和审评的要点既是药品审评关注点,也是上市后监督检查的关注点,建议在制订我国药品连续制造审评和检查细则指南时充分加以考虑。借鉴国外连续制造相关研究成果,有助于科学地推动我国连续制造监管考量不断发展,以适应制药产业当前的实际发展需求。
参考文献
[1] 胡延臣. 药品连续生产及全球监管趋势[J]. 中国新药杂志,2020,29(13):1464-1468.
[2] 李香玉,梅妮, 陈桂良. 美国食品药品监督管理局关于“新兴制药技术”的监管理念与实践[J]. 中国药事,2020,34(7):836-839.
[3] Lee SL,O’connor TF, Yang X, et al. Modernizing
Pharmaceutical Manufacturing: from Batch to ContinuousProduction[J]. Journal of Pharmaceutical Innovation,2015,10(3):191-199.
[4] 国家药品监督管理局药品审评中心. 关于公开征求ICH指导原则《Q13:原料药和制剂的连续制造》意见的通知[EB/OL].(2021-10-19)[2021-12-05]. https://www.cde.org.cn/main/news/viewInfoCommon/d30747763265e07fae058d565519070e.
[5] ISPE. Continuous OSD Manufacturing - A Product & Patient Perspective[EB/OL].(2018-05-17)[2021-
12-06]. https://ispe.org/pharmaceutical-engineering/ispeak/continuous-osd-manufacturing-productpatientperspective.
[6] EMA. Assessment Report: Orkambi(lumacaftor /ivacaftor), EMEA/H/C/003954/0000)[EB/OL].(2018-10-16)[2021-12-06]. https://www.ema.europa.eu/documents/assessment-report/orkambi-epar-publicassessment-report_en.pdf
[7] Bell, J. “J&J Still Has Much to Explore with Continuous Manufacturing.”Biopharma Dive[EB/OL].(2018-09-24)[2021-12-06]. https://www.biopharmadive.com/news/jnj-johnson-continuous-manufacturing-lessons-learnedprezista/532405/.
[8] ISPE. Meet Eli Lilly and Company - 2017 FOYA Process Innovation Winner[EB/OL].(2017-05-03)[2021-12-06]. https://ispe.org/pharmaceutical-engineering/ispeak/meet-eli-lilly-and-company-2017-foya-processinnovation-winner
[9] EMA. Assessment Report: Daurismo(Glasdegib, EMEA/H/C/004878/0000)[EB/OL].(2020-04-30)[2021-12-06]. https://www.ema.europa.eu/documents/assessmentreport/daurismo-epar-public-assessment-report_en.pdf
[10] EMA. Assessment Report:Symkevi(Tezacaftor / Ivacaftor, EMEA/H/C/004682/X/0015/G)[EB/OL]. (2020-09-17)[2021-12-06]. https://www.ema.europa.eu/documents/variation-report/symkevi-h-c-4682-x-0015-g-epar-assessment-report-variation_en.pdf
[11] EMA. Assessment Report: Kaftrio(Ivacaftor / Tezacaftor
/ Elexacaftor, EMEA/H/C/005269/0000)[EB/OL].
(2020-07-10)[2021-12-06]. https://www.ema.europa.
eu/documents/variation-report/kaftrio-epar-publicassessment-report-variation_en.pdf
[12] ISPE. Regulatory Aspects of Global Acceptance ofContinuous Manufacturing[EB/OL].(2021-06-01)[2021-10-08]. https://ispe.org/pharmaceuticalengineering/july-august-2021/regulatory-aspects-globalacceptance-continuous
[13] ICH. Q13: Continuous Manufacturing of Drug Substances and Drug products, Step 2 Document – to be Released for Comments[EB/OL].(2021-08-12)[2021-12-05]. https://database.ich.org/sites/default/files/Q13_Step2_
Presentation_2021_1004.pdf.
[14] FDA. Advancement of Emerging Technology Applications for Pharmaceutical Innovation and Modernization Guidance for Industry[EB/OL].(2017-09-01)[2021-12-05]. https://www.fda.gov/media/95444/download.
[15] EMA. Mandate for Process Analytical Technology Team
[EB/OL].(2006-12-08)[2021-12-06]. https://www.
ema.europa.eu/en/documents/other/mandate-processanalytical-technology-team_en.pdf.
[16] EMA. Mandate of the EMA Innovation Task Force(ITF)
[EB/OL].(2014-08-06)[2021-12-06]. https://www.
ema.europa.eu/en/documents/other/mandate-europeanmedcines-agency-innovation-task-force-itf_en.pdf.
[17] FDA. Quality Considerations for Continuous Manufacturing:
Guidance for Industry[EB/OL].(2019-02-01)[2021-
10-08]. https://www.fda.gov/media/121314/download.
[18] FDA. Guidance for Industry:PAT—A Framework for Innovative Pharmaceutical Development,Manufacturing,and Quality Assurance.[EB/OL].(2004-10-01)[2021-10-08]. https://www.fda.gov/media/71012/
download.
[19] EMA. Guideline on the Use of Near Infrared Spectroscopy by the Pharmaceutical Industry and the Data Requirements for New Submissions and Variations[EB/OL].(2014-01-27)[2021-10-08]. https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-use-nearinfrared-spectroscopy-pharmaceutical-industry-datarequirements-new_en-0.pdf.
[20] FDA. Development and Submission of Near Infrared Analytical Procedures:Guidance for Industry[EB/OL].(2021-08-01)[2021-10-08]. https://www.fda.gov/media/91343/download.
撰稿人 | 曹辉,李香玉等
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多