业绩发布 | 君实生物发布2022年度业绩
2022年是君实生物成立的第十年。作为一家年轻的创新型生物制药企业,我们在2022年的业务发展迅猛,在各项业务运营、对外合作、产业链拓展、人才储备及在研药物开发等方面均取得不凡成绩。
基于过去10年公司自主建立的从研发到产业化的全流程覆盖能力,我们一方面依托在美国旧金山湾区、马里兰、苏州和上海设立的研发中心进行早期开发和临床研究,实现全球范围内的自研与对外合作;另一方面,借助在苏州吴江和上海临港的生产基地加速产业化进程,助推产品的商业化落地。
截至目前,我们的在研管线已超过53项,其中2022年以来已有10款新药获准进入临床试验(包括3项中美双报),新增2款产品(君迈康®、民得维®)实现商业化。不断扩充的研发技术平台和开放多元的合作创新为我们带来了源源不断的持续创新动力。
随着公司商业化能力提升,以及核心产品拓益®(特瑞普利单抗)在2022年新增食管癌、肺癌领域2项大适应症获批上市,我们在国内市场的销售情况已逐步进入正向循环。后续面对临床研究的加速,越来越多一线治疗、围手术期治疗及术后辅助治疗领域的关键注册临床陆续完成,预计拓益®将有更多新适应症进入上市申报(sNDA)阶段。处于临床后期的产品昂戈瑞西单抗、senaparib也有望先后达成临床阶段的里程碑,预计在年内进行上市申报。
而在出海方面,拓益®的全球商业化网络更是进入了快速拓展期,海外授权累计覆盖超过30个国家。不仅在欧美市场有多项适应症的上市申请正在接受美国、欧盟、英国监管机构的审评,还积极开拓新兴市场,于近期与Hikma、康联达宣布合作,携手进军北非、中东、东南亚市场。与此同时,公司首款“全球新”产品tifcemalimab、TAB006/JS006(TIGIT)、TAB009/JS009(CD112R)等在研品种均取得了国际临床进展。遵循“立足中国,布局全球”的国际化战略,我们步履不停,旨在让优质的中国创新成果惠及海外患者。
2021年11月,民得维®获准进入临床试验阶段。在随后将近1年的时间里,我们的研发团队快速推进项目进展,药物最终于2023年1月28日在中国附条件上市。从中和抗体埃特司韦单抗到民得维®,从《自然》到《新英格兰医学杂志》,3年来我们实现了2款抗新冠新药的研发和上市接力,充分显示出公司面对全球公共卫生事件时强大的研发实力以及勇于挑战和突破的创新精神。我们期待民得维®能够在“乙类乙管”的新形势下,为更多COVID-19患者提供效果更好、更安全的治疗选择。
十年间,君实生物见证并参与了中国生物医药产业的飞速发展,曾创造了国内乃至国际药物研发领域的多个“第一”,也曾在突发公共卫生事件中挺身而出。
下一个十年已经开启,我们将带着伟大的使命和梦想,朝着更远大的目标迈进!

财务摘要
截至2022年12月31日:
公司实现营业收入14.53亿元。
❖
其中拓益®(特瑞普利单抗)销售收入7.36亿元,同比增长78.77%。
研发投入23.84亿元,同比增长15.26%。
❖
主要用于研发管线扩充,研发进度推进,合作研发项目投入。
现金及现金等价物59.97亿元。
❖
2022年12月,公司A股成功募集资金37.765亿元。
*中国企业会计准则计量
业务摘要
1
产品管线
截至目前,我们拥有53+项在研产品,覆盖5大治疗领域,包括恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统疾病以及感染类疾病。
中国/海外市场商业化:4项
拓益®、君迈康®、民得维®、埃特司韦单抗
临床试验阶段:近30项
III期临床:昂戈瑞西单抗、贝伐珠单抗、PARP抑制剂
临床前开发阶段:20+项
创新研发领域已覆盖超过6种药物类型
单抗、小分子药物、多肽类药物、抗体药物偶联物(ADCs)、双特异性或多特异性抗体药物、核酸类药物等更多类型的药物,以及癌症、自身免疫性疾病的下一代创新疗法
已授权专利达到121项
国内94项、境外27项
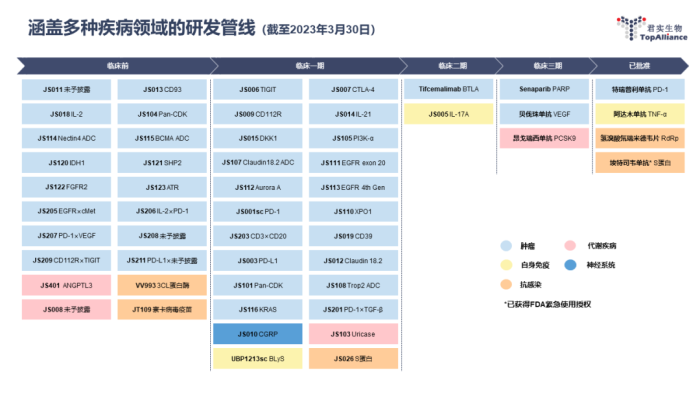
君实生物研发管线
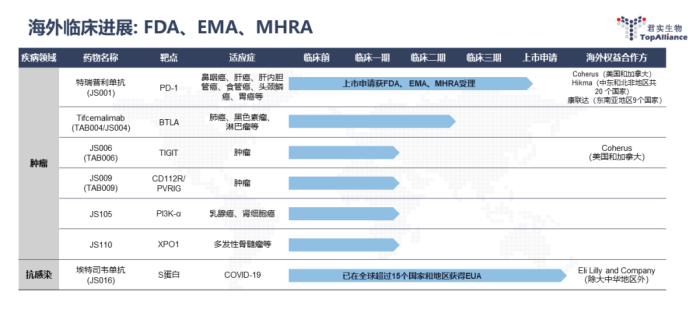
海外临床进展
商业化产品:
“肿瘤+自免+新冠”多点开花
特瑞普利单抗(商品名:拓益®)
公司自主研发、中国首个成功上市的国产抗PD-1单抗
在中国、美国、东南亚和欧洲等地累计开展了覆盖超过15个适应症的30多项临床研究
中国商业化及临床开发成果
国内销售步入正向循环
销售收入7.36亿元,同比增长78.77%;
累计在全国超过4000家医疗机构,约2000家专业药房及社会药房销售。
构建多层次医疗保障,减轻患者负担,惠及更多患者
已纳入国家医保的3项适应症可在全国137个地市进行补充报销;
国家医保外的适应症已纳入33个地市的商业保险特药目录,可在约100个城市进行商业保险的补充报销。
2项大适应症获批上市
5月,联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗;
9月,联合培美曲塞和铂类适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗。
1项III期临床研究完成首例患者给药
2月,联合标准化疗作为胃或食管胃结合部腺癌根治术后的辅助治疗III期临床研究(JUPITER-15)。
2项III期临床研究达到主要研究终点,计划于2023年向NMPA提交sNDA
2023年1月,联合含铂双药化疗用于可手术非小细胞肺癌患者围手术期治疗的随机、双盲、安慰剂对照、多中心III期临床研究(Neotorch);
2023年2月,联合注射用紫杉醇(白蛋白结合型)治疗首诊IV期或复发转移性三阴性乳腺癌的随机、双盲、安慰剂对照、多中心III期临床研究(TORCHLIGHT)。
海外商业化及临床开发成果
获得第6项FDA孤儿药资格认定(ODD)
4月,用于治疗小细胞肺癌
美国、欧盟、英国上市申请正在审评中
7月,FDA受理了重新提交的特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的BLA;
12月,EMA受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗、特瑞普利单抗联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的MAA;
2023年2月,MHRA受理了上述两项适应症的MAA。
海外业务拓展累计超过30个国家
12月,与Hikma制药达成合作,将在中东和北非地区共20个国家进行开发和商业化;
2023年3月,与康联达签约,将设立合资公司在东南亚9个国家进行合作开发和商业化。
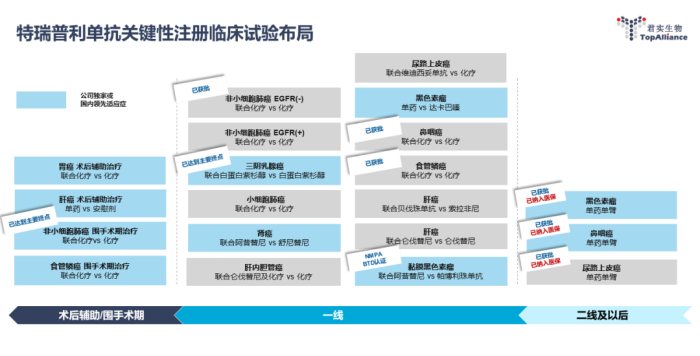
特瑞普利单抗关键性注册临床试验布局
学术发表成果
食管鳞癌、非小细胞肺癌、鼻咽癌、胆道系统肿瘤、黏膜黑色素瘤、头颈鳞癌等领域围手术期/新辅助/辅助/晚期一线治疗研究成果发表
《肿瘤学年鉴》(Annals of Oncology,IF:51.769)、《临床肿瘤学杂志》(Journal of Clinical Oncology,IF:50.739)、Cancer Cell(IF:38.585)、The Innovation、Journal of Experimental & Clinical Cancer Research(IF:12.658)、Signal Transduction and Targeted Therapy( IF:38.104)
ASCO 2022、ASCO Plenary Series、AACR 2022、ESMO 2022、ESMO-IO、ASH 2022
阿达木单抗(商品名:君迈康®)
公司与迈威生物合作开发的阿达木单抗,公司第三款商业化产品
累计获批8项适应症
3月、11月,获批用于类风湿关节炎、强直性脊柱炎、银屑病、克罗恩病、葡萄膜炎、多关节型幼年特发性关节炎、儿童斑块状银屑病、儿童克罗恩病治疗
民得维®(氢溴酸瑞米德韦片,VV116/JT001)
新型口服核苷类抗SARS-CoV-2药物,可抑制病毒复制
12月,全球权威期刊《新英格兰医学杂志》(The New England Journal of Medicine,NEJM,IF:176.082)发表VV116与PAXLOVID“头对头” III期研究成果
2023年1月28日,VV116获NMPA附条件批准上市,用于治疗轻中度COVID-19成年患者
临床阶段候选药物:
创新引领高质量临床
2022年以来,我们已新增10+款创新药物获准进入临床试验阶段,其中3款为“中美双报”。
Ⅲ期阶段
昂戈瑞西单抗(JS002)
公司自主研发、国内首个获得临床试验批件的国产抗PCSK9单克隆抗体
2023年2月,2项主要关键注册临床研究已顺利完成,均达到主要研究终点
用于原发性高胆固醇血症和混合型高脂血症治疗
1项II期研究已完成(纯合子型家族性高胆固醇血症),1项III期研究已完成入组(杂合子型家族性高胆固醇血症)
计划于2023年向NMPA提交新药上市申请
Senaparib(JS109)
与英派药业成立合资公司共同研发的PARP抑制剂
作为一线维持治疗铂类药物敏感性晚期卵巢癌患者的III期临床研究已完成患者入组,正在等待临床数据评估
若达到临床预设终点,计划于2023年向NMPA提交新药上市申请
贝伐珠单抗(JS501)
与华奥泰生物合作研发的VEGF抑制剂
III期临床研究正在进行中
Ⅱ期阶段
Tifcemalimab
(TAB004/JS004)FIH
公司自主研发的全球首个进入临床开发阶段的抗肿瘤抗BTLA单抗
处于Ib/II期剂量扩展阶段
于中国和美国两地正在开展和特瑞普利单抗在多个瘤种当中的联合用药试验
在ASCO 2022和ASH 2022年会上发表用于实体瘤和淋巴瘤治疗的早期临床成果
正与FDA和NMPA就启动注册临床试验沟通交流,如获同意,公司计划在2023年内开展国际多中心III期注册临床研究
抗IL-17A单抗(JS005)
公司自主研发的特异性抗IL-17A单克隆抗体
2项II期临床研究已完成锁库揭盲(中重度银屑病、强直性脊柱炎)
疗效结果达到预期,安全性良好,已启动注册临床试验沟通交流,即将进入III期注册临床研究
1项II期研究正在开展中(放射学阴性中轴型脊柱关节炎)
Ⅰ期阶段
抗TIGIT单抗(TAB006/JS006)
公司自主研发的重组人源化抗TIGIT单克隆抗体
1月,Coherus启动行使TAB006/JS006在美国和加拿大的许可选择权的程序
已在中国完成I期临床试验,将按照相关规定开展联合特瑞普利单抗以及标准治疗的II期临床试验
抗CTLA-4单抗(JS007)
公司自主研发的重组人源化抗CTLA-4单克隆抗体,主要用于晚期恶性肿瘤的治疗
I期临床研究入组正在进行中
抗CD112R单抗(TAB009/JS009)
公司自主研发的靶向CD112R的重组人源化单克隆抗体,用于晚期恶性肿瘤的治疗
CD112R(PVRIG)是公司发现的全新免疫检查点通路
4月、8月,在中国和美国获得临床批准
将按照相关规定在中国和澳洲开展TAB009/JS009的I期临床试验
IL-21融合蛋白(JS014)
公司通过许可引进的重组白介素21-抗人血清白蛋白(HSA)单域抗体融合蛋白,通过融合抗HAS的单域抗体使IL-21的半衰期得到显著延长
I期临床研究入组正在进行中
抗DKK1单抗(JS015)
公司自主研发的重组人源化抗DKK1单克隆抗体注射液,主要用于晚期恶性实体瘤的治疗
I期临床研究入组正在进行中
PI3K-α抑制剂(JS105)
公司引进的靶向PI3K-α的口服小分子抑制剂,拟用于治疗晚期恶性实体瘤,如乳腺癌等
5月、7月,在中国和美国获得临床试验批准
I期临床研究入组正在进行中
抗Claudin18.2单抗-MMAE偶联剂
(JS107)
公司自主研发的靶向肿瘤相关蛋白Claudin18.2的抗体偶联药物(ADCs),拟用于治疗胃癌和胰腺癌等晚期恶性肿瘤
3月,在中国获得临床试验批准
I期临床研究入组正在进行中
XPO1抑制剂(JS110)
公司引进的核输出蛋白XPO1小分子抑制剂,临床上拟用于治疗晚期肿瘤病人
8月,在美国获得临床试验批准
I期临床研究入组正在进行中
EGFR exon20插入等非常见突变
抑制剂(JS111)
公司引进的一种有效抑制EGFR非常见突变的靶向小分子抑制剂,有望给携带EGFR exon20插入突变等EGFR非常见突变的肿瘤患者带来新的治疗方式
I/II期临床试验正在进行中
AuroraA抑制剂(JS112)
公司引进的一款高选择性口服小分子Aurora A抑制剂
2月,在中国获得临床试验批准
I期临床研究入组正在进行中
第四代EGFR抑制剂(JS113)FIC
公司引进的潜在first-in-class第四代EGFR抑制剂,拟用于EGFR突变非小细胞肺癌和其他实体瘤的治疗
6月,在中国获得临床试验批准
I期临床研究入组正在进行中
抗CD20/CD3双特异性抗体
(JS203)
公司自主研发的重组人源化抗CD20和CD3双特异性抗体,主要用于复发难治B细胞非霍奇金淋巴瘤的治疗
7月,在中国获得临床试验批准
I期临床研究入组正在进行中
抗PD-1单抗皮下注射液
(JS001sc)
公司在特瑞普利单抗基础上开发的皮下注射制剂
I期临床研究入组正在进行中
ANGPTL3 siRNA药物(JS401)
公司与润佳共同研发的一种靶向血管生成素蛋白3(ANGPTL3)信使RNA(mRNA)的小干扰RNA(siRNA)药物,拟主要用于高脂血症等治疗
2023年1月,IND申请获得NMPA受理
合作创新:积极开展研发合作探索
微境生物:引进四款小分子抗肿瘤药物
JS120(第二代不可逆IDH1抑制剂)、JS121(SHP2抑制剂)、JS122(第二代不可逆FGFR2选择性抑制剂)、JS123(ATR抑制剂)
中山大学肿瘤防治中心:免疫治疗增效活菌生物制剂
“一种细菌在制备免疫检查点抑制剂的增效剂中的应用”等
2
生产基地:临床、商业产能双升级

苏州吴江生产基地
4,500L(9*500L)发酵能力

上海临港生产基地
42,000L(21*2,000L)发酵能力
❖
荣获首批上海市智能工厂
❖
国家智能制造优秀场景等
3
夯实ESG管理,不断提升企业成长能力
纳入上证180指数、恒生A股可持续发展企业基准指数的成分股(精选ESG表现最优10%企业)
关于君实生物
君实生物(688180.SH,1877.HK)成立于2012年12月,是一家以创新为驱动,致力于创新疗法的发现、开发和商业化的生物制药公司。公司具有由超过50项在研产品组成的丰富的研发管线,覆盖五大治疗领域,包括恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统类疾病以及感染性疾病。
凭借蛋白质工程核心平台技术,君实生物身处国际大分子药物研发前沿,获得了首个国产抗PD-1单抗国家药品监督管理局(NMPA)上市批准、国产抗PCSK9单抗NMPA临床申请批准、全球首个治疗肿瘤抗BTLA阻断抗体在中国NMPA和美国FDA的临床申请批准,目前正在中美两地开展多项Ib/II期临床试验。
自2020年疫情暴发之初,君实生物迅速反应,与国内外科研机构及企业携手抗疫,利用技术积累快速开发了多款预防/治疗COVID-19的创新药物,积极承担中国制药企业的社会责任。其中包括:国内首个进入临床阶段并参与全球抗疫的新冠病毒中和抗体埃特司韦单抗(JS016)于2021年在超过15个国家和地区获得紧急使用授权,新型口服核苷类抗新冠病毒药物民得维®(VV116/JT001)已在中国和乌兹别克斯坦获得批准,以及其他多种类型药物,持续为全球抗疫贡献中国力量。
目前君实生物在全球拥有约3000名员工,分布在美国旧金山和马里兰,中国上海、苏州、北京、广州等。
内容来源:君实生物
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
人工智能在生物医药领域的应用前景分析及对策建议
2025-11-14
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多