国内外药品工艺验证指南解读
国际人用药品注册技术协调会(ICH)于2017年6月19日,正式公布原中国国家食品药品监督管理总局(CFDA)加入其成为成员国,意味着中国药品监管和药品注册技术要求与国际协调一致的紧迫性和必要性。通过对中国、美国、欧盟、世界卫生组织(WHO)等关于药品生产工艺验证指南的学习,结合经验及实例,对国内外生产工艺验证要求进行解读,确定基于风险的、生命周期工艺验证方法即现代工艺验证方法,已经得到国内外权威监管机构及制药企业的的认可。
正文
2017年6月19日,原中国国家食品药品监督管理总局(CFDA)正式加入国际人用药品注册技术协调会(ICH),其重要意义被业界评价为不低于中国加入WTO。然而,加入ICH只是国际化之路的开始,对中国的制药领域,思考及解决如何协同中国药品监管要求和药品技术要求与国际一致、制定适合中国制药国情的可操作指南,是意义更加深远的伟大工程,而工艺验证作为保证药品质量、安全和有效性的重要环节,同样也是国内大部分企业薄弱的环节,正越米越受到制药企业和监管机构的重视。2015年5月原CFDA出台了新版GMP附录《确认与验证》,首次提出了持续工艺确认的概念,而这一概念在欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)及世界卫生组织(WHO)关于药品验证的章节,也有明确的阐述,通过对比可以确定,基于风险的、生命周期的工艺验证方法即现代工艺验证方法已经成为国际主流的药品工艺验证指导规范。
本文以ICH成员为基础,对比主流药品监管机构如美国、欧盟、WHO等关于药品工艺验证指南规范要求,结合经验及实例,重点以美国注射剂行业协会技术报告PDA TR60为例,对基于风险评估的、生命周期的工艺验证方法进行解读,旨在为医药企业的药品工艺验证的规范实施提供参考。
1.国内外主流药品工艺验证相关指南汇总
WHO、欧盟EMA及美国FDA对工艺验证的要求,已经阐述了基于风险评估的、生命周期的工艺验证方法,相信中国的药品工艺验证相关要求的修订与国际要求接轨,将成为必然趋势,笔者对WHO、欧盟、美国等药品GMP规范中关于工艺验证的指南进行了汇总,见表1~5。
2.基于风险的、生命周期工艺验证方法
生命周期指从产品最初的开发到上市直至产品停产退市的所有阶段。ICH QI0生命周期的质量管理理念已经被国内外制药企业和监管机构广泛用于工艺验证实践和指导指南中。
WHO、美国FDA工艺验证指南及其行业协会PDA TR60中,均明确工艺验证包含3个阶段,即第一阶段:工艺设计(process design),第二阶段:工艺确认(process qualification),第三阶段:持续工艺确认(continued process verification),充分阐述了基于科学认知的、风险管理的生命周期工艺验证方法及现代工艺验证方法。WHO、欧盟、美国等在工艺验证中均强调了药品生命周期和各阶段质量风险管理,国内外药品工艺验证的异同点分析见表6。
3.工艺验证的实施策略
美国注射剂协会20I3年发表的技术报告PDATR60(生命周期的工艺验证)整合了ICHQ9、Q10的要求,系颇具代表性的生命周期工艺验证方法,它包含的信息能够使生产厂家实施全球认可的工艺验证程序,该程序与最近的基于生命周期的工艺验证指导文件和现行对药品质量系统的期望相一致。
下面将结合实践经验,重点对PDATR60进行学习解读。
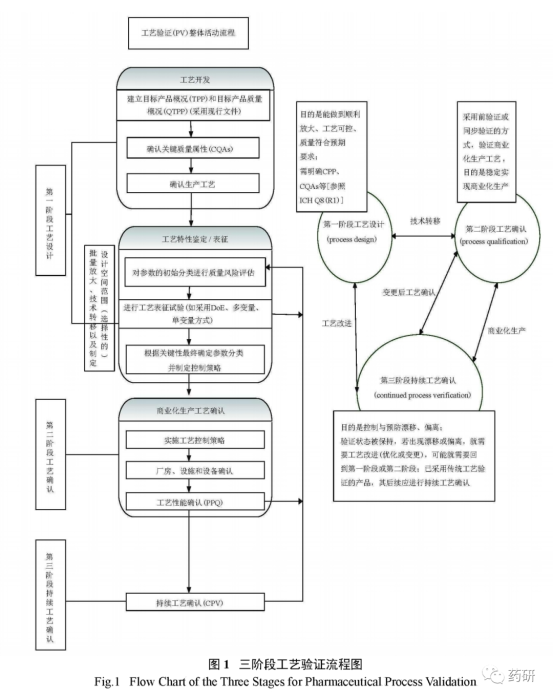
3.1三阶段工艺验证流程(图1)
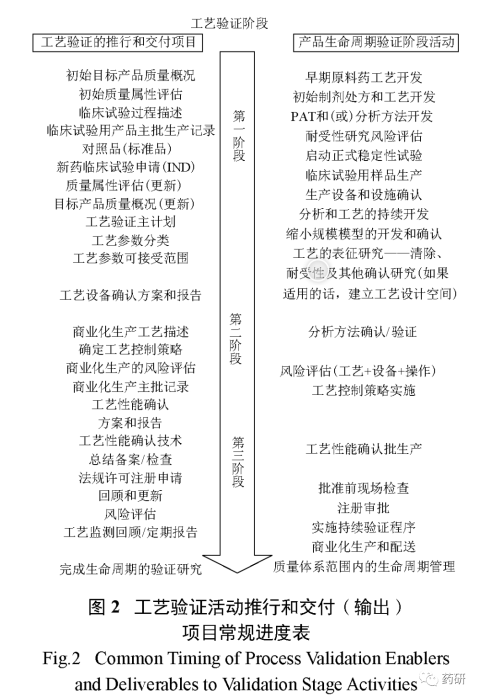
3.2工艺验证活动推行和交付(输出)项目常规进度表(图2)
需要说明的是,验证生命周期中,从第一阶段过渡到第二阶段,不是严格按照顺序的,部分第一阶段工作可能与第二阶段工作同步完成。同样,部分第二阶段工作也会与第一阶段的后期工作同时启动。
3.3质量风险管理:一种生命周期的开发和验证工具
ICHQ9质量风险管理理念应贯穿整个工艺验证生命周期,包括对第一阶段工艺设计阶段CQAs、控制策略等的评估确定、第二阶段统计取样计划的制定、第三阶段持续工艺确认监控策略的制定等。其中,在第一阶段工艺设计期间执行风险评估是为制定控制和监控变量做准备,也能决定持续监控应该进行到什么程度才可以保证常规的商业生产处于控制状态:风险管理第二阶段,即工艺验证生命周期中的工艺确认阶段具有更多的策略性,评估可以帮助确认在工艺的什么阶段需要进行什么级别的检测,可以用于对设计阶段的工艺控制策略进行微调:而第三阶段持续工艺确证是整个工艺验证生命周期中最长的一个部分,其开始于工艺能力的评估,通过对工艺表征、工艺性能确认(process performance qualification,PPQ)和历史数据的输出的审核来保持持续,当商业化生产开始是由对PPQ数据的审核确定的时候,需要采用加强的取样方式,工艺能力可以帮助确定某一属性的加强取样的级别,并确定应该保持该级别取样的持续时间,在风险评估当中,工艺的统计学意义与发生率直接相关,工艺越稳定,潜在失效模式发生率会越低,工艺整体的风险越低,风险的等级也可以确定一定产品和工艺属性的审核周期。
3.4三阶段工艺验证解读
3.4.1第一阶段:工艺设计(process design)
工艺设计通常包括实验设计、工艺开发、临床试验用药品的制备、中试生产和技术转移。基于生命周期的工艺验证方法,已经将验证的周期向前延伸至工艺设计阶段,提出可采用中试规模批次进行验证性工艺研究,批量至少为商业批的10%或10万片,选二者中最大者,目的是确认商业化批次工艺验证的可行性,本阶段验证的工艺研究批次是否需要3批取决于工艺的复杂性和对工艺及产品的理解程度,一般应考虑起始物料的变量,确认设备和生产工艺的一致性,采用基于统计分析的实验设计方法,有助于此阶段的验证研究。
第二阶段的工艺验证和第三阶段的持续工艺验证,总是和工艺设计紧密联系的,当上市后发生变更,有可能由第三阶段返回至第一阶段,重现3个阶段的流程,直至评估工艺持续稳定、可控,具体需要视变更的影响程度决定。
中国的工艺验证未对工艺设计做明确规定,但2010版 GMP 第九条“药品的设计与研发体现本规范的要求”的描述,一定程度上体现了对研发工艺设计阶段的要求。
3.4.2第二阶段:工艺确认( process qualification )
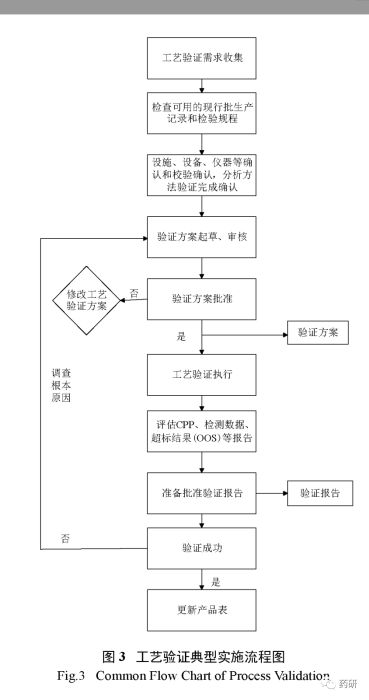
工艺确认又可进一步细分为2a和2b阶段,2a类似于原有概念的设施、设备确认,即对设施、设备、共用工程系统的设计和确认[设计确认( DQ )、安装确认( IQ )、操作确认( OQ )、性能确认( PQ )等];2b为 PPQ ,可理解为原有概念的3批工艺验证,工艺性能确认主要为了证明工艺变量的可控性以及生产出符合预定质量属性的产品的能力,在 PPQ 过程中,应适当增加取样和分析实验来证明工艺受控和中间步骤、成品的一致性。可采用 WHO 工艺验证指南中提出的新理念﹣连续性工艺性能确认( continuous process performance )的方法开展 PPQ (现代工艺验证手段),主要利用先进的生产和过程分析技术( PAT )如在线( on - line )、在位( in - line )、近线( at - line )检测等手段,及时监控工艺性能和产品质量,工艺性能可被连续不断地检测和评价,一般只适用于制剂产品。工艺确认通常应采用前验证的方法,特殊情况下可采用同步验证。目前制药界工艺验证的通用做法是采用传统工艺验证方法和现代工艺验证结合的方式,传统工艺验证方法已经取消了回顾性验证,限制了同步验证的使用,推荐采用前验证方法,只有当可导致药物短缺、市场需求极小无法连续验证批次生产等存在情况下,才有可能采用同步验证,同步验证通常只适用于因变更引起的验证,不能作为常规方法使用。以本公司原料药或制剂产品工艺验证组织实施为例,工艺验证(即第二阶段 PPQ )常规实施流程通常流程见图3。
3.4.3第三阶段:持续工艺确认( continued process verification , CPV )verification , CPV )
持续工艺确认是为了确保产品生命周期内维护在“受控”的状态,又可进一步分为3a和3b阶段,2个阶段的区别主要体现在取样和检测频率上。通过2b阶段后,产品尽管可以投放市场,但对于高风险、工艺能力低的关键工艺参数,需要维持2b阶段的高强度取样,即3a阶段,直到有足够的统计学数据证明变异可控、可接受,才能转为正常的取样频率即3b阶段。
应将阶段性的高强度取样和监测,作为持续改进的一部分,提高对工艺的理解,收集并评估工艺的变化趋势,如进场物料、组分的质量,过程监测和终产品监测结果以及不符合项等,以此验证原始工艺验证的有效性,并可用于明确控制策略是否需要进行相应的变更,以有效控制工艺和产品质量,在产品生命周期中,应定期对持续工艺确认范围进行审核评估,并在有需要时进行修订。
4小结
基于风险管理的、生命周期的工艺验证方法已经成为药品质量管理体系的一部分,越来越受到制药企业和监管机构的认可,本文通过对国内外主要工艺验证指南要求的对比,对三阶段工艺验证(生命周期方法)的实施基础和操作流程进行了解读,基于科学的、质量风险管理的工艺验证理念,虽已在2015年公布的新版 GMP 附录《确认与验证》中有一定程度的体现,但在工艺设计阶段的规范性、科学性要求仍缺失,对我国药品研发的规范性提出更高的挑战,需要监管机构与行业不断进行完善。在实施工艺验证过程中,很多制药企业是基于惯性方法进行操作,一成不变、教条式理解工艺验证,未真正实施基于良好科学基础的、风险评估的工艺验证理念,在工艺验证主计划的制定、取样、监控、持续工艺确认的实施、对技术转移的重视等诸多方面均存在很多不足,尤其是对持续工艺确认的理解,仍与再验证和质量回顾等混淆、一致对待,存在不科学性,亟待规范。笔者通过梳理国内外药品日常监管检查披露的缺陷发现,工艺验证实施不充分、文件不合理或不具有操作性的缺陷越来越受到关注,希望通过本文,可以一定程度上指导制药企业规范开展工艺验证活动,更好地支持制药企业的“走出去”战略。
作者|张兰平 王媛
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略



















评论
加载更多