内卷之下,双抗ADC迎来风口
Part
1
风暴来临,先锋折戟。
2022ESMO大会上,美股上市公司Zymeworks发布了在研的HER2双抗ADC产品——ZW49,治疗实体瘤的I期临床数据不达预期,导致股价发生暴跌。这无疑给双抗ADC药物在研企业带来压力。
虽然先锋遇冷,但区别于前代肿瘤治疗方法,双抗ADC药物的优势依然前瞻明显。
结合了双抗和ADC优势的双抗ADC药物,是一个更为崭新的概念。相较于单抗,一方面,通过双抗更加特异性地靶向肿瘤细胞,增加药物的安全性;另一方面,通过交联作用促进两个靶点的协同内吞,在提高毒素进入肿瘤细胞效率的同时,进一步通过减少受体蛋白在细胞膜上的表达量来抑制肿瘤细胞生长信号,达到更好的治疗效果。
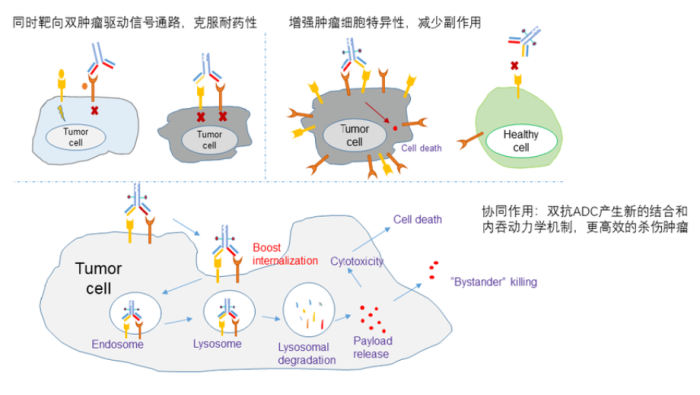
双抗ADC的作用机制及其优势
如此看来,具有多重优势的双抗ADC,未来将成为诸多药企百舸争流的新赛道。
但因该方向的研究尚处发展阶段,故临床前的在研产品不多。原因大致有二:
一、能够用于双抗构建的抗体骨架分子较少,且靶点非常集中,仅在HER2、HER3、EGFR、MUC1等几个靶点上有较好的可选抗体分子,缺少足够的“骨架”来快速搭建稳定表达的双抗ADC分子;
Part
2
目前,海内外均有药企在进行双抗ADC的临床中或者临床前的研究。
1
Zymeworks:ZW-49
ZW-49是Zymeworks利用其专有的Azymetric™ Bispecifics和ZymeLink™ ADCs平台共同开发得到的双特异性抗体ADC药物。能够同时特异性结合HER2受体的两个非重叠表位,即帕妥珠单抗结合位点和曲妥珠单抗结合位点。以期在临床应用中,对于曲妥珠单抗、帕妥珠单抗,甚至TDM-1等新型ADC药物耐药的患者,起到良好治疗效果。鉴于ZW-49具有的巨大潜力,2018年,百济神州与Zymeworks Inc.就ZW49及ZW25的临床开发和商业化达成了战略合作。
ZW49的抗体部分采用了与ZW25(双特异性抗体,同时结合HER2的两个非重叠表位)类似的抗体结构,通过Zymelink的技术,连接的Payload为化疗药物auristatin衍生的微管抑制剂,在患者体内,理论上能实现与ZW25类似的HER2结合效果,从而在癌细胞内部释放携带的细胞毒性物质,起到最大杀伤效果。在小鼠肿瘤模型中,ZW49表现出比T-DM1和DS-8201更强的抗肿瘤活性。
2021年1月,Zymeworks公布了ZW-49的I期临床的部分数据。结果显示,ZW-49在所有治疗方案和剂量水平上均显示出抗肿瘤活性。在Q2W和Q3W两种给药方案中均观察到部分环境(PR)和疾病稳定(SD)。且在所有接受ZW-49治疗的35名患者中,没有出现治疗相关的血液毒性、肺毒性及肝毒性。90%以上不良反应为轻度或中度。
2
阿斯利康:MEDI4276
其为双表位四价HER2 ADC药物。MEDI4276,以39S(表位类似于帕妥珠,全人源抗体,识别domain 2)为骨架,连接了trastuzumab(识别domain 4)的scFv结构。39S和曲妥珠单抗的识别表位位于HER2 ECD的相反端,彼此相距>90 Å。DAR为4,linker为maleimidocaproyl linker,毒素为tubulysinwarhead。但MEDI4276临床开发,却受到重挫,以至于终止开发。MEDI4276确实实现了对曲妥珠单抗、帕妥珠单抗和TDM1治疗耐受的患者,展现了一定疗效。但毒性问题,却造成整个项目的夭折。
在整个ADC领域,毒性问题主要的引发点,其实多数来源于linker/payload,而MEDI4276却出现了一定程度的靶向毒性,引起DLT。所以,双表位ADC在解决抗原低表达药物无响应问题的同时,其毒性问题,是非常值得思考的,也是一个非常大的隐患。在毒素毒性程度的选择,甚至DAR的选择上都要去有所思考,而非简单粗暴行事。ZW49做了一定的改进,目前,只展现了初步的临床疗效,并不惊艳,但尚未出现MEDI4276相关的严重的毒性问题,仍可以继续爬坡,其后续结果仍值得期待。
3
百利药业:BL-B01D1
BL-B01D1是由百利药业开发的靶向EGFR/HER3的双特异抗体ADC。除了双抗ADC,目前百利药业也布局了EGFR/HER3的双特异抗体。从其发表的专利来看,EGFR/Her3双抗的结构可能如下图所示,为完整抗体上融合scFv的2+2对称型结构(以企业披露为准)。
作用机制方面,BL-B01D1不仅可以同时阻断EGFR、HER3与配体的相关结合,而且其与EGFR、HER3结合后可以通过细胞内吞进入细胞内部,由水解酶酶切释放小分子毒素ED04,阻止肿瘤细胞的DNA复制和RNA合成,并破坏DNA结构,从而进一步杀伤肿瘤细胞。目前该药物已经在国内进入临床。
4
康宁杰瑞:JSKN003
JSKN003是由康宁杰瑞开发的靶向HER2的双特异抗体ADC。该双特异抗体是在KN026基础上的改造和设计,其和ZW-49类似,都是靶向HER的两个不同表位(ECD4/trastuzumab和ECD2/pertuzumab)。JSKN003利用特定位点偶联,DAR值为3-4,无论在HER2低表达的BxPC-3动物模型中还是在HER2高表达的N87 CDX模型中,其疗效和第一三共的ENHERTU(DS-8201a )相当。另外,在稳定性方面,JSKN003在血清中展现了良好的稳定性,因此理论上可能会有更好的安全性。
除了开发双抗ADC药物外,康宁杰瑞目前也在布局双抗偶联调节剂相关药物。
5
Regenron:REGN5093- M114
REGN5093- M114是由Regenron开发的靶向MET两个不同表位的双抗ADC。该抗体为1+1非对称型双特异抗体,通过M114 linker将抗体与毒素M24(美登素衍生物)连接,DAR值为3.2左右。其可以同时结合两个MET的不同的表位,并可以有效的阻断HGF与MET的结合,从而可以防止相关通路的激活;另外,抗体结合肿瘤细胞表面的MET后,抗体和MET形成的2+2型复合物可以被内化,进入肿瘤细胞并在溶酶体中被降解,从而可以减少MET通过再循环表达在细胞表面。
除此之外,REGN5093-M114中可以被酶切的linker在溶酶体中被酶切后释放M24毒素并通过作用于微管蛋白来抑制肿瘤生长。
与其它抗体不同,REGN5093-M114裸抗本身同样具有一定的抑制肿瘤的效果,并且在临床前的多种模型中展现了良好的药效。目前再生元已经将裸抗REGN5093和ADC双抗REGN5093-M114两种药物都推向了临床。
6
Sutro+默克:M1231
M1231是Sutro和默克合作开发的一款靶向MUCI/EGFR双特异抗体ADC。该双特异抗体ADC采用了Sutro非天然氨基酸定点偶联技术,并通过默克的SEED双特异抗体技术平台防止两条重链的错配。其中靶向MUCI的抗体为scFv,而靶向EGFR的抗体为Fab形式,该设计不存在传统双抗中的轻链错配问题。
在生产中,该抗体的表达采用Sutro的无细胞体系XpressCF,并且在生产过程中定点插入非天然氨基酸,以利于后续双特异抗体的定点偶联。毒素方面采用微管抑制剂hemiasterlin,并通过可裂解的Val-Cit连接子将抗体与毒素偶联。
默克之所以选择MUCI/EGFR作为靶标,是因为相关研究表明,MUCI/EGFR共表达在多种肿瘤细胞中,如ESCC、NSCLC、SCCHN等,而且其共表达在正常组织中非常低,因此理论上可以降低On-target毒性,提高用药窗口。另外,其研究表明抗体同时结合肿瘤表面的两种抗原,使得抗体快速内吞,并释放响应的毒素抑制肿瘤细胞的生长。
在临床前的PDX动物模型中,8mg/kg单剂量治疗小鼠可以在一定程度上抑制肿瘤的生长甚至清除肿瘤。目前该药已经进入临床。
7
百奥赛图:YH012
百奥赛图的双抗ADC是在其RenLiteTM双特异抗体平台上构建的, RenLiteTM利用共同轻链的方法防止双特异抗体轻链的错配,同时采用Knob-In-Hole防止抗体重链错配,该平台可以实现高纯度双特异抗体的生产。在此基础上,其利用链间半胱氨酸进行偶联,linker为可裂解的二肽VC(valine-citrulline),毒素为MMAE。
在NCI-N87肿瘤细胞中,靶向Her2/TROP2的双抗ADC YH012可以被肿瘤细胞快速内化,并且其内化效率由于单靶点的对照ADC药物。
Part
3
目前ADC赛道日趋拥挤,但双抗ADC结合了双抗和ADC的特性和复杂性,需要充分理解作用机制和作用原理,因此具有更广的竞争优势。目前,双抗ADC仍处于起步阶段,至于其安全性和有效性放是否具有更好的表现还需要在临床上进一步验证。
对比欧美日等发达地区,国内企业应以差异化为核心,从原创出发,拥抱新方向,是大势所趋。而深入了解ADC的内吞作用和机制——ADC在体内发挥药效中极其重要的第一步,是第一突破口。
另外,如果单考虑保守,认为在低风险情况下就能做出更好的ADC,无疑是画地为牢。要真正静下心来,从机制出发,刻苦钻研,从内部打破,才能孕育新生命。
1.《双抗ADC药物的进展及隐患!》,药时代,2022-03-01.
2.《新一代治疗性抗体——双抗ADC药物》,百奥赛图,2022-03-09.
3.《双抗的下一站:双抗ADC?》,抗体圈,2022-07-27.
4.《一条优于双抗、ADC的赛道?海外先驱受挫,国内几家药企笑了》,瞪羚社,2022-09-26.
END
来源 | 贝壳社
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多