大批药品,将退出市场
01
未过一致性评价药品批文
或退出
近日,全国政协经济委员会副主任、中国国际经济交流中心常务副理事长毕井泉在第五届虹桥国际经济论坛上表示,要明确未通过一致性评价药品文号的退出政策,研究按药品文号收取年度监管费,迫使多年不生产的僵尸文号退出市场,减轻监管压力。
毕井泉指出,目前通过一致性评价和按新标准批准上市的仿制药已经有5238个品规,覆盖近九百个品种,但仅相当于医疗机构经常使用药品的一半。
毕井泉提出要发展高质量仿制药。解决药品可及的根本性措施是发展仿制药。要继续鼓励企业开展仿制药一致性评价,落实有关奖励政策,抑制恶性竞争,保证中标药品质量和供应。
据据库数据,我国国产化学药品批文总数最高峰时有128626条。截至2022年4月,我国国产化学药只剩下92189条批文。在一致性评价等政策的综合作用下,大批药品正逐渐被清出市场。
截至目前,国内开展一致性评价工作已经6年时间,从美国、日本推行仿制药一致性评价的经验来看,仿制药一致性评价是一个长期的过程——日本经历22年,美国23年。
未来,随着一致性评价政策的持续推进,药品批文还将深度洗牌。
针对未通过一致性评价药品文号的退出政策,今日一位业内专业人士表示,严格来说,一致性评价的完成时效限制和不做一致性评价的处罚严肃性都不明确,但是其认为这一政策激发的市场淘汰已很明显。
据上述专家了解,一致性评价成本一直很高,一个口服制剂的一致性评价价格在600万元-800万元。有的规模比较小的企业,做一致性评价主要是为了保留一些批文在市场上维持生存。而且从目前的情况来看,很多头部的企业基本能做的已经都做了,它们甚至率先进入到了缩减仿制药投入的阶段。
针对一致性评价政策触发的退出机制,按照《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)规定:化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。
化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
后来,《国家药品监督管理局关于仿制药质量和疗效一致性评价有关事项的公告》(2018年第102号)提出,《国家基本药物目录(2018年版)》已于2018年11月1日起施行并建立了动态调整机制,与一致性评价实现联动。通过一致性评价的品种优先纳入目录,未通过一致性评价的品种将逐步被调出目录。对纳入国家基本药物目录的品种,不再统一设置评价时限要求。
至于化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,3年时限内逾期未完成的,企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请。
关于延期的时限问题,赛柏蓝查询后发现,河北省药监局2018年12月28日发布的《关于仿制药质量和疗效一致性评价有关事项的公告》政策解读明确,经研究认定为临床必需、市场短缺品种的,可适当予以延期,原则上不超过5年。届时仍未完成的,药监部门不予批准其药品再注册申请。
随着药监部门不再批准注册,没有通过一致性评价的药品批文也将退出医药市场的舞台。
前述专家指出,政策清理药品批文的过程也是清理药厂的过程。以日本通过一致性评价前后药品批文许可情况来看,在20世纪70年代,日本和我国现在数量情况基本相似,有10万余个药品批文许可,到2013年药品批文许可还剩下不到1.9万个,市场上实际流通的有效批文为1.5万个左右。
批文减少了,药厂可以用做一致性评价的钱去购买其他批文。清退僵尸批文,可以提高产业的集中率。毕竟药企是否开展一致性评价主要是看是否有利益可图,如果无利可图,企业可能就不会做了。
从各省最近的动作来看,未过一致性评价的品种正在被暂停挂网——这也是产品部分退出市场的信号。
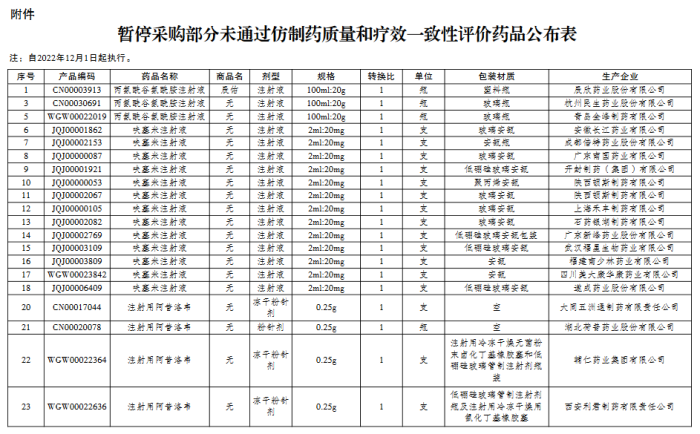
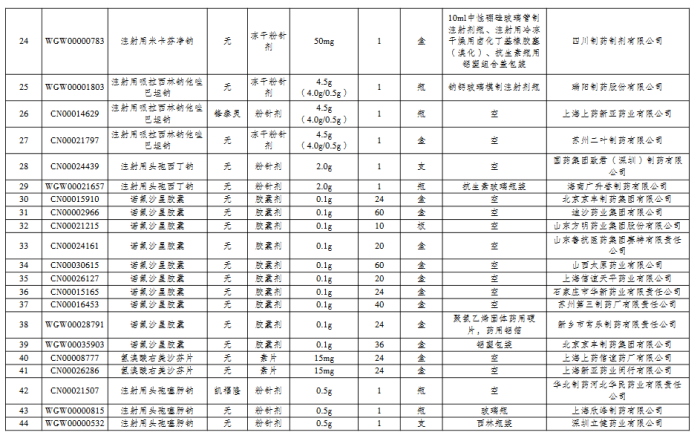
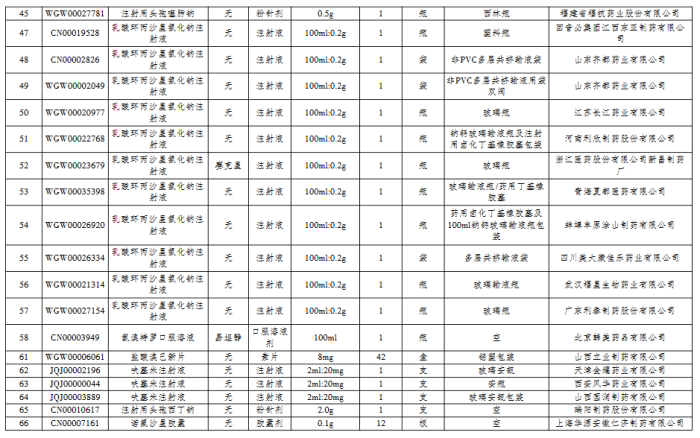
赛柏蓝梳理发现,江西、江苏等省曾多次发布过关于暂停采购未通过仿制药和疗效一致性评价药品的通知。
11月8日,江苏省公共资源交易中心发布《关于暂停采购部分未通过仿制药质量和疗效一致性评价药品的通知》,包括注射用阿昔洛韦、注射用哌拉西林钠他唑巴坦钠、诺氟沙星胶囊在内的66个产品将于12月1日起暂停采购,涉及上海上药新亚、国药集团致君(深圳)制药、山东鲁抗医药集团赛特、上海信谊天平等多家知名药企。
一致性评价已经成为药品准入的关键筛选方式,从首家过评开始,关于产品、市场、价格方面的博弈已经开启,过评满3家后,淘汰机制开启,未过评的药品将无缘院内市场。
至于未来会不会有更多的退出机制,有业内人士预计后续会有更多加快批文退出的政策。
02
批文洗牌持续
多家药企减少仿制药业务
2016年,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》(国办发(2016)8号),明确了仿制药一致性评价的具体目标和时间,一致性评价工作正式开始;2020年,注射剂一致性评价工作也宣布启动。
赛柏蓝在国家药监局官网查询发现,截至10月20日,国家药监局共发布关于仿制药参比制剂目录六十一批。从公布的参比制剂目录来看,各种剂型中,片剂最多,其次是注射剂和胶囊剂。
赛柏蓝发现,随着仿制药要求的提高,对参比制剂的选择也提出了更高的标准。由于仿制药申报一致性评价首先要有参比制剂,同用药途径同通用名产品没有参比制剂的产品则无法申报仿制药一致性评价,也就是说这类产品也“无缘”进入国家集采。
当然,这也意味着同类的产品批文视同长期有效。近来,这类没有参比制剂的国内已上市的产品成为了药品上市批文交易的热点。
至于一些常规的仿制药,一位从业者对赛柏蓝表示,虽然还剩余大量的药品没有做一致性评价,但是预计一些企业不会再立项了,大部分企业会慎重立项。
行业强者恒强,放到一致性评价上也是一样。“一个药品批文开展一致性评价要800万元上下的投资,不少药企一年的利润都没有800万元。”
在市场机制的驱动下,仿制药对于很多药企来说,不再是“好生意了”。
2018年,恒瑞就曾因仿制药激烈竞争,选择停掉一般仿制药项目,表示只做创新药和有核心价值的高端仿制药;
2020年正大天晴、华东制药等也都对外宣称要停掉低壁垒、低商业价值的仿制药开发,转向有核心价值的高端仿制药和创新药;
2022年,四环制药宣布计划在未来12–24个月内逐步出售仿制药等传统业务。
有分析指出,带量采购不断推进仿制药进入微利时代,仿制药一致性评价持续开展,无法和原研对标的仿制药将失去市场准入资质,乐观估计我国化学药企业和生物企业总数将会在500家左右,药品批文也将大幅减少。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多