ADC药企不想「隐入尘烟」,就一定要办好立项这件「人生大事」! 原创
如今,PD-1的容量已趋于饱和,谁能开启下一个全球大战呢?
答案一定包括ADC,非它莫属!
ADC(Antibody Drug Conjugate),即抗体偶联药物,被誉为“魔术子弹”、“生物导弹”。组成部分包括:抗体、载药、连接子。ADC药物通过连接子将单抗和药物分子偶联在一起,利用抗体的特异性靶向运输药物分子到靶组织发挥作用,从而降低药物的系统性毒副作用,提高药物治疗窗和拓展抗体治疗潜能。
截止目前,已经有包括著名的DS-8201在内的14款ADC新药在全球获批,400多款ADC新药正在火热研发中。中国药企在ADC赛道的表现也十分亮眼。荣昌生物、科伦博泰、石药等,频频出售自研的ADC项目给欧美大药企,交易金额之高,影响力之大,令海外药企瞩目,成为中国新药成功出海的范例。
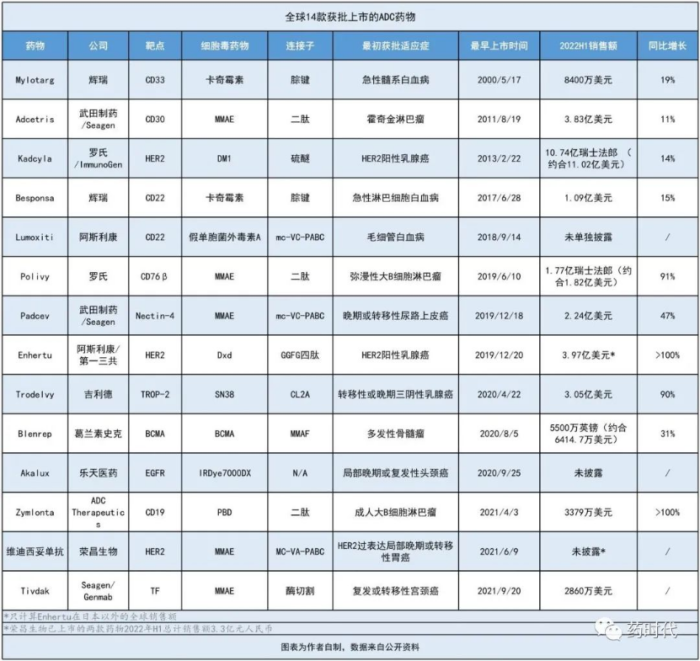
图2.(图片来源:药时代)
根据Evaluate Pharma和BCG的预测,全球ADC市场预计2024年将达到129亿美元,2018年至2024年的年复合增长率约为35%,2026年更是有望达到160多亿美元。庞大的市场规模、超乎预期的临床成功、技术平台的研发创新,高效推动ADC创新药物从实验室研发迈向产业化和商业化。
ADC火热已为行业所公认,甚至都已经有些过热了,默沙东开价400亿美元要收购ADC赛道老牌企业Seagen,GSK更是直接投资14.6亿美元购买了一款还处于临床前阶段的ADC药物,令人咂舌。仅2020一年内,ADC领域就有约400亿美元交易完成,其中阿斯利康与第一三共达成合作,联合开发后者的多款核心在研ADC药物,为此在短短一年半内就斥资130亿美元。无独有偶,2020年9月13日,吉利德科学宣布210亿美元收购Immunomedics,轰动一时,至今仍余波未尽。
大战,一触即发!
称ADC为下一个PD-1,既对也不对,对在火热程度相当,不对呢,则是因为ADC是一个更考验研发实力的赛道。
K药、O药等一众的PD-1以及PD-L1新药都是单抗,是非常成熟的分子实体,尽管机制复杂,但在制造工艺上难度有限。
相比之下,ADC药物的工艺要复杂得多,不同的组分及合成工艺都需要不同的相配套的生产车间。IND申请所需的CMC资料,至少是单抗的三倍。需要特别指出的是,ADC药物的载药部分通常是高活性、高毒性的成分,所以相关的生产环节对质量和安全性的要求比普通生物药高很多、严格很多,这意味着企业可能需要花超过十亿美元建设厂房设备、建立相应的质量和安全操作标准体系等。
此外,企业还需要培训非常专业的人员来按照标准流程操作。对于ADC企业而言,研发失败或上市后销量不达预期的话,这样硬件、软件等方方面面的投入可能会造成巨大浪费。基于成本高、生产难度大、投资回报不确定等因素,目前全球ADC药企将70%的工序都委托给了CDMO公司。
对于小分子药物和抗体药物,企业往往建立一条包括多款在研药物的丰富而平衡的管线。基于ADC分子的复杂程度、苛刻的技术要求、高昂的研发生产成本,采用这样的策略变得非常的不实际,公司需要把有限的资金“砸”在最有希望成功的一款ADC药物上,所有鸡蛋放在一个篮子里,风险会变得极大。
艾伯维的Rova-T曾是一款备受瞩目的ADC药物。其选择的靶向的DLL-3蛋白约在80%的小细胞肺癌(SCLC)患者中表达,而正常组织中极少表达,是理想的ADC药物靶点。2016年发表一期研究数据,在DLL-3>50%的患者中达到了38%的客观缓解率,有望打破SCLC后线治疗几十年无进展的僵局,引起了行业震动。
但遗憾的是,在后续的确认性研究中,无论是一线、二线还是联用都未能重复此前的研究数据,如今已经听不到Rova-T的大名。且由于艾伯维过于自信,跳过二期临床,直接开展多项三期临床,导致研发成本巨大,损失高达58亿美元。
对大公司来说,三期失败尽管损失巨大,但也并非不可承受,而对于biotech来说,二期临床的失败足以造成毁灭性打击。
2022年5月13日,一家小型biotech公司CytomX Therapeutics公布了其ADC候选药物Praluzatamab ravtansine的二期临床研究数据,由于结果不及预期,CytomX决定不再单独推进该项目,而该产品的失利也间接导致CytomX在两个月后裁员40%,以维持现金流。
即便是ADC的龙头企业第一三共也难免在该领域折戟。
2021年10月29日,第一三共在发布的季报中宣布,放弃DS-6157的研发,这是一款靶向胃肠道间质瘤(GIST) GPR20蛋白的ADC药物,被放弃的原因是在 I 期剂量递增的任何剂量水平下,对 GIST患者均未产生明确反应。
第一三共尚不能保证候选药物的I期临床成功率,何况是跟着Follow的企业?扎堆在PD-1的企业,如果失败,原因大概率是药品上市后销售不及预期,而扎堆在ADC的企业,失败的结果可能会是连产品都做不出来。
所以,如何高效筛选出一款高质量、差异化的PCC(临床前候选药物)对ADC赛道的玩家至关重要,无论候选药物效果好还是不好,最好都在临床前就能进行验证。
第一三共的另一款爆款ADC药物DS-8201便是在临床前就展现出了极大的潜力。早在2016年,一篇有关DS-8201的体外评估报告就发表在了Cancer Science上,内容包括细胞系的选用、平行人工膜通透性测定、体外细胞生长试验、体内异种移植研究、体内荧光素酶成像、免疫组化分析等。
在经过了与抗HER2-DXd、T-DM1的严格对照分析后,可以看出DS-8201在诸多体外、体内模型上都表现出较大优势。
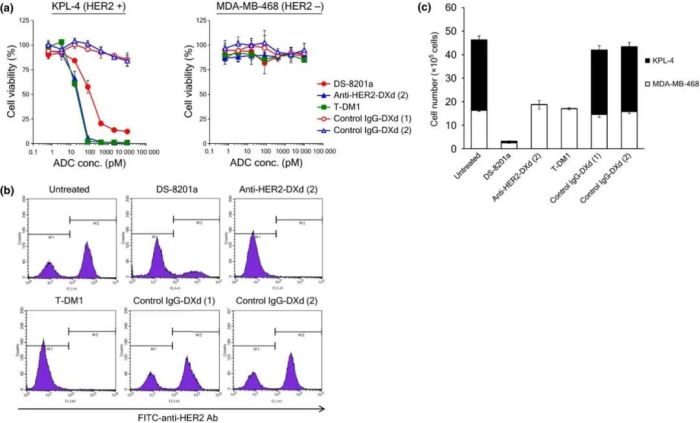
图3:a.ADCs 对 KPL-4 和 MDA-MB-468 细胞的生长抑制活性。b.流式细胞仪分析数据。c.KPL-4 和 MDA-MB-468 活细胞的数量。(来源:Cancer Sci.2016 Jul;107(7):1039-46)
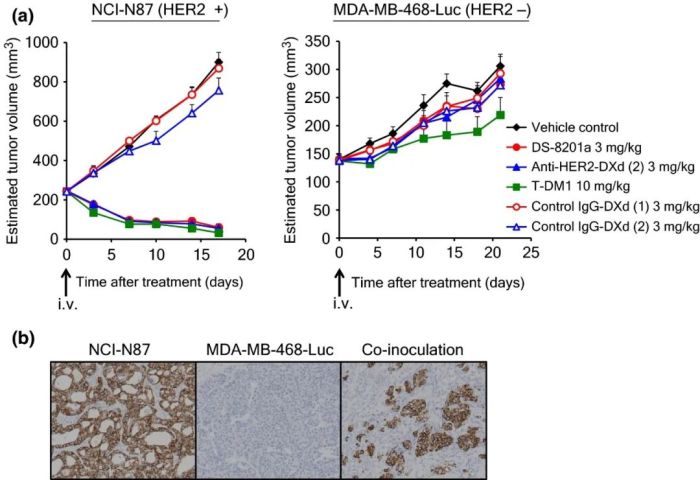
图4:a.ADC 在 NCI-N87 和 MDA-MB-468-Luc 异种移植模型中的抗肿瘤活性。b.HER2在共同接种的肿瘤中的表达。(来源:Cancer Sci.2016 Jul;107(7):1039-46)
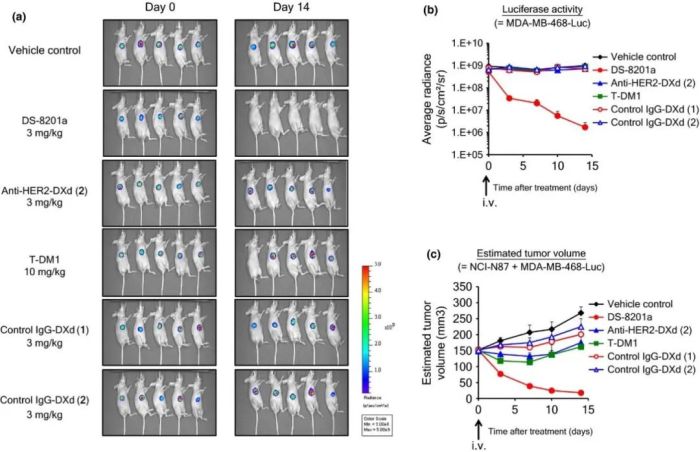
图5:a. 荧光素酶活性的成像数据。b.萤光素酶活性。C. 估计的肿瘤体积。(来源:Cancer Sci.2016 Jul;107(7):1039-46)
今年ASCO会场上ADC新药DS-8201报告后全场响起了经久不息的掌声。这种场面已经在全球制药界销声匿迹多年,正是这样的临床前数据,让第一三共敢于在三期临床中让DS-8201与T-DM1进行头对头对照研究分析,为其后续的成功打下了基础。
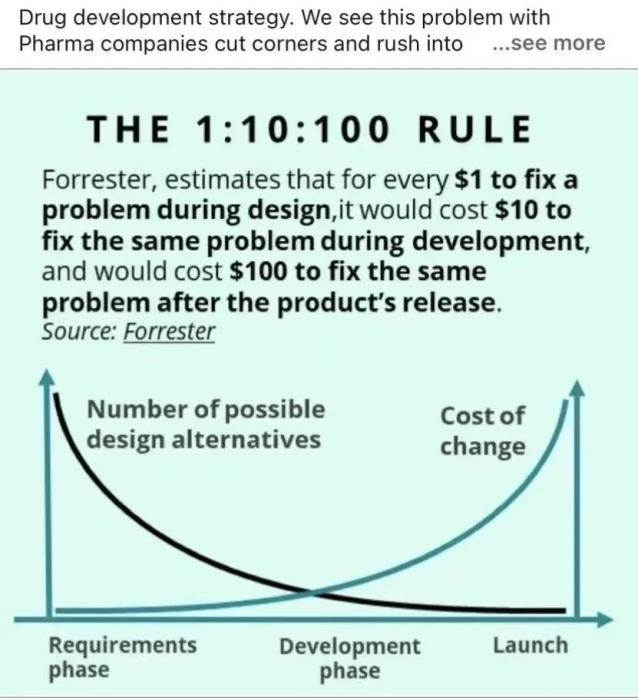
回溯小分子、大分子等药物的研发历程便会明白,扎实的临床前研究可以提升药物获批上市的成功率。用一句大家都耳熟能详的口头语表示,就是:赢在起跑线!
正如1:10:100原则描述的那样,在早期阶段,拥有的选择更多,试错的成本更低。这与海外制药界专业人士经常挂在口头的那句“Fail Early,Fail Cheap”是同一个意思。
今年7月中国CDE发布了《抗体偶联药物非临床研究技术指导原则(征求意见稿)》,为临床前的ADC药物开发明确了方向。

图7:(来源:NMPA官网)
不久前,在《ADC药物的临床前药理药效评价》的主题讲座中,冠科生物科学事务部亚太区负责人钟翊翔博士对该指导原则的方方面面进行了细致的解读。
据钟博士介绍,CDE的ADC指导原则强调了ADC药物的药理药效研究的重要性,并指出了一些关键细节。新药研发企业如何根据指导原则确认PCC分子的成药性,相应开展符合IND要求的实验,就显得非常重要。
一个值得关注的现象就是,国内布局ADC赛道的CDMO企业很多,比如:药明合联、迈百瑞、东曜药业、臻皓生物,但提供ADC药物相关的临床前研究的优质企业好像不是很显眼。
在美国,不可重复的临床前研究每年浪费280亿美元,国内的情况应该也不乐观。所以,对于ADC赛道的药企而言,把临床前研究做好、做扎实,才有可能不仅赢在起跑线,赢得整场比赛,也可以节省大量的资金。
冠科生物成立于2006年,已发展成为一家全球新药研发技术平台公司,提供肿瘤体内及体外模型药效测试、药物筛选、药物代谢分析及转化医学领域等研究,在美国、英国、荷兰和中国均有运营实体。

为了满足ADC这条火热赛道中众多家研发企业的刚需,这位CRO老将与时俱进,对自身业务进行整合,推出了一套符合IND申报的一站式药理药效服务平台,已赋能众多药企和生物科技企业的各类大小分子药物以及ADC分子的中美欧澳等IND申报。目前拥有3000多个PDX肿瘤模型、700多株合规肿瘤细胞系及超500个肿瘤类器官模型,以及上下游相关的基因测序、蛋白分析、细胞检测和组织器官病理分析平台。
在ADC药物的开发方面,冠科生物提供一站式的药理药效研究和IND申报服务平台。以上文CDE提到的ADC药物相关药理研究要点,包括:ADC与靶点的亲和力检测;ADC内吞能力确认;游离毒素对细胞产生的作用;体外肿瘤细胞抑制实验;体内肿瘤模型药效模型;旁观者杀伤效应;ADC Fc端介导功能;靶点受体介导功能;PK和毒理服务等。
对于药企而言,尤其是对于当下身处靶点扎堆、内卷严重、竞争激烈的中国药企而言,基于多癌种、多器官、多靶点这些特征,ADC的的确确是一个不可多得的新药研发黄金赛道。ADC比PD-1能「容纳」更多玩家。一代ADC、二代ADC、三代ADC已经上市,四代ADC还远吗?四代ADC有实力挑战DS-8201吗?但是,以DS-8201为代表的的已上市的ADC新药超水平发挥,不断攻城掠地,抢占下一个个适应症,甚至开辟了HER2低表达这一新的阵地,又让ADC赛道「容不下」大部分玩家。
全球布局ADC赛道的多家知名药企接连披露,自己公司的临床试验和开发受到DS-8201强势发展的负面影响,与DS-8201存在包括患者资源、临床试验速度、申报速度等方面的竞争。迫于压力,公司对研发管线做战略调整、战略放弃,有的甚至换掉CEO。
最后,我们借用最近非常火热的两部电影大片的名字来做个总结。在这样一个充满寒气的大环境下,做好临床前研究,选择高质量、有实力的PCC推进到临床,是每一家药企面临的一件「人生大事」。

如果一味地走“捷径”或简单地copy,忽视临床前研究工作的重要性或重视程度和投入不够,那么这些药企很可能逐渐落伍,最终「隐入尘烟」。

-
引领药物筛选新变革,提高药物研发成功率——浅谈冠科生物与类器官(PDO)技术 | 药时代专访冠科生物徐小溪博士 -
营收翻倍,助力50%近年FDA批准的癌症创新药物的开发!——李其翔博士分享中美冠科快速扩张的秘密
-
第四届中美冠科国际生物医药研讨会 · 6月30日 上海 张江 -
有梦最美,希望相随!——看好中国,布局全球,中美冠科将落户中山! -
集合优势 全力发挥 中美冠科助中国企业早日摘取新药研发皇冠上的明珠! -
不一样的动物模型,同一个新药梦想!——中美冠科的CVMD故事 -
新技术浪潮下,人源化动物模型能否化冲击为动力,为新药研发再次赋能? -
既生PDX,何生PDO(organoids)?试看登上《科学》封面的类器官如何助力新药研发! -
HER2 ADC终结者?!「DS-8201」断送了多少新药的“锦绣前程”? -
ADC药物创新之路 -
迄今商业化最成功的ADC:Kadcyla -
ADC有效载荷及研究进展详述 -
ADC 爆发,半年营收翻倍,阿斯利康......
-
ADC交易价格4年翻4倍:大药厂越卷,Biotech越嗨
-
浅谈ADC药物的发展势头
-
Mersana下一代ADC技术平台
-
104家中国新药企业扬帆出海!ADC赛道喜讯频传!科伦博泰势头赶超老大哥石药 | 药时代出海系列
-
肿瘤细胞如何“服毒自尽”? 多款ADC药物内吞特征解析
-
提前4个月!FDA批准ADC药物Enhertu(DS-8201)用于治疗「HER2低表达」乳腺癌患者,市场有望扩大5倍!
-
国产ADC喜讯频传!Claudin18.2开发,中国药企已领先全球,「并购」与「合作」或将成为新趋势
-
二审败诉!重磅ADC药物Enhertu依旧被判侵权。盘点药企专利之争,厉害的药全被告了...
-
有望打破ADC局限?LegoChem基于其新型ADC平台ConjuAll ,与 Glycotope达成一项研究合作和许可协议
-
现在的ADC,像极了当年的PD-1
-
哪款产品将“制霸”ADC领域:已上市ADC药品全球销售额预测排行榜
-
DS-8201又一适应症申报上市,多种国产ADC突围思路及代表企业梳理
-
今晚8点!王晓稼教授、罗晟教授和肖亮博士为您解读「ADC的爆款、热点和未来」!| 「国际CMO学苑」第4期活动
-
国内ADC竞争格局
-
重磅传闻!制药巨擘默沙东正在评估收购ADC“学霸”Seagen的可能性。Seagen股价大涨!
-
大话ADC——爆款、热点和未来!| 「国际CMO学苑」第4期活动
-
摸索中前进:盘点ADC连接子的升级之路
-
ADC生物偶联技术的最新研究进展
-
DS-8201“统治”HER-2靶点,国内ADC玩家谁能迎战
-
恒瑞医药研发HER3 ADC
-
ADC药物的耐药机制
-
昨晚,AZ/第一三共发布公告。DS-8201「肺癌适应症」也快获批了,抗HER2的ADC们要考虑下一步该怎么走了...
-
刚刚!重磅ADC药物DS-8201,获NMPA受理,AZ为它花了69亿美元!
-
近30年不能成药的潜力靶点,成为了「巨头绞肉机」,ADC能使其成为下一个「PD-1一样」的爆款吗?
-
面对DS-8201的压力,罗氏选择将T-DM1降价52%,HER2 ADC即将迎来大混战
-
双抗ADC药物的进展及隐患!
-
全球仅一款药物获批,年销售额可达「40亿美元」!——ADC靶点新星:TROP-2
-
第三代ADC的发展历程如火如荼,一起了解它的发展历程
-
“生物导弹”ADC, 研发热潮正当时
-
吉利德2021:瑞德西韦56亿美元、Trop2 ADC 3.8亿美元
-
同质化ADC药物制造,选择性位点修饰策略
-
FDA批准的ADC代表性结构
-
药明直播间 | 冠状病毒药物和疫苗药效平台介绍;ADC药物的临床前药效和转化研究
-
【药咖君】中药再度爆发!尿路上皮癌迎来首款ADC,两款乳腺癌新药获批,恒瑞药业、荣昌生物…
-
ADC技术的专利布局策略分析
-
2021年国内ADC融资盘点
-
辉瑞创新ADC疗法在华获批,可治疗白血病
-
万字长文!ADC烽烟四起,III期临床群雄逐鹿:老牌玩家的“内”与“外”;HER2靶点之争;新靶点“三剑客”,创新不止于靶点
-
不容忽视的“连接技术”:ADC竞争的最后一公里
-
同台打擂!CD19靶点集CAR-T、双抗、单抗、ADC四路“开花”
-
ADC领军biotech公司荣昌生物科创板上会稿重点内容!
-
收藏!ADC全景概况(payload,linker,conjugate和Endocytosis)
-
2021年ADC药企融资盘点(1-10月)
-
德琪医药与LegoChem Biosciences达成新型抗体偶联药物(ADCs)合作开发和许可选择权协议
-
群雄割据,抗体偶联药物(ADC)靶点新星-Trop2 争夺大战一触即发
-
宫颈癌新药 | 全球首款ADC获批,双抗还远吗
-
NEJM:ADC药物治疗非小细胞肺癌临床试验,效果显著
-
HER2 ADC创新浪潮!科伦、荣昌、复星...竞技特长几何?
-
乳腺癌抗体治疗格局:单抗/双抗/ADC百花齐放!
-
ADC冰火两重天!明星公司股价跌至一块钱。CMC真的很关键!
-
新靶点ADC药物的临床进展
-
重磅消息扎堆!艾迪药业抗艾滋新药获批上市;国内首款MUC1 ADC新药获批临床;GSK艾滋病新药商业上市。。。
-
BMS也过“618”!斥资31亿美元购买卫材ADC药物Halaven
-
抗体药物偶联物(ADC):肿瘤治疗领域的“魔术子弹”
-
干货!从ASCO大会看国内双抗、ADC与CAR-T最新临床研究成果
-
Bioconjugate Chemistry期刊重点推荐!中科院有机所王文元、王召印团队报道双功能ADC新平台
-
盘点FDA批准的超100款抗体药物!双抗、ADC…新的爆发点在哪里?
-
“魔法子弹”ADC药物100亿黄金赛道竞争加剧!国产追赶加速,2款已申报上市,云顶新耀、荣昌生物....
-
TROP2-ADC角逐战:第一三共公布最新进展,国内百奥泰失利后谁扛旗?
-
首款靶向CD19的ADC新药Zynlonta获批!助力大B细胞淋巴瘤治疗
-
重磅消息扎堆!礼来乳腺癌新药中国供货开始、齐鲁引进MUC1 ADC药物、渤健多发性硬化新药获批、默沙东终止一新冠药物研发。。。
-
ADC蓄势待发:11种上市产品和在研新药将争夺百亿美元市场
-
首款靶向ADAM9的ADC—IMGC936
-
重磅消息扎堆!索伦托4.88亿美元收购艾森医药;百济神州广州生物药生产基地获批;齐鲁下一代ADC获批3期;吉凯与天境合作。。。
-
ADC药物崭露头角?齐鲁、石药、恒瑞...
-
获批及在研ADC药物和靶点一览,预测肿瘤市场规模超160亿美元
-
谢雨礼博士 | 新药大时代:小分子突破,双抗ADC爆发,RNA王者归来,生物相变能否成就下一个诺奖?
-
胃癌 | 继乳腺癌之后,阿斯利康/第一三共ADC药物Enhertu被FDA批准治疗HER2+胃癌
-
全球首个三阴乳腺癌Trop-2 ADC药物III期研究结果惊艳亮相
-
Seagen接替Seattle Genetics,这位先驱与他的ADC药物是否即将开启新的健康篇章?
-
ADC药物研发的关键四要素及发展趋势
-
药明直播间|生物制药系列(三):迎接挑战,打破创新壁垒——抗体偶联药物ADC定制化解决方案
-
60亿美元大单再掀ADC风潮,国内公司能否在巨头环伺中乘风破浪?
-
2020年全球ADC药物研发报告
-
PPT分享 | 抗体偶联药物ADC行业研究——治疗癌症的魔术子弹
-
Immunomedics抗体偶联药物(ADC)临床试验提前结束 股票大涨 -
2020年即将上市的ADC药物及点评
-
早鸟票最后一天!PD-1,PDO,Protac,Biosimilar,ADC, 抗癌药大会荟萃行业热点!
-
FDA批准首个化学免疫疗法!基因泰克ADC药物Polivy!针对复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)
-
天演药业授权ADC Therapeutics使用新一代抗体精准掩蔽技术开发安全抗体偶联药物
-
特瑞思药业ADC药物TRS005喜获临床试验批件
-
抗体偶联药物(ADC)研究报告(下)| 凯泰资本生物技术团队
-
抗体偶联药物(ADC)研究报告(上)| 凯泰资本生物技术团队
-
Seattle Genetics取消了血癌药物SGN-CD33A全部临床研究,ADC药物研发再次遇挫
-
放眼欧洲,这10家生物企业“牛气轰轰”(BioNTech、Oxford Nano、CRISPR、ADC……)
-
【小编】抗体偶联药物(ADC)研究报告
-
祝贺!基因泰克和药明康德科学家发明新型ADC接头技术 -
Ogitani Y, Hagihara K, Oitate M, Naito H, Agatsuma T. Bystander killing effect of DS-8201a, a novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity. Cancer Sci. 2016 Jul;107(7):1039-46. -
其它公开资料
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多