定制化大孔填料在生物大分子纯化中的应用优势
定制化大孔填料在相对传统填料生物大分子纯化中有以下优势:
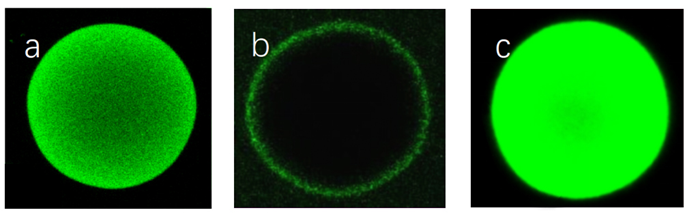
生物大分子如乙肝抗原、类病毒等在经过层析填料纯化时,孔径是限制这些大分子进孔吸附的关键因素,增大孔径有助于增大大分子在填料上的载量。如下图所示:琼脂糖DEAE填料对小分子BSA静态吸附载量达到几十毫克,小分子BSA在填料表面和内部均可观察到;同样的填料对大分子HBsAg静态吸附载量只有不到1毫克,大分子HBsAg只能吸附在填料表面,无法进入内部孔道构;而对定制化大孔DEAE,大分子HBsAg可以进入其内部孔道,定制化大孔DEAE填料对于大分子HBsAg的吸附载量几乎是琼脂糖DEAE填料的20倍。
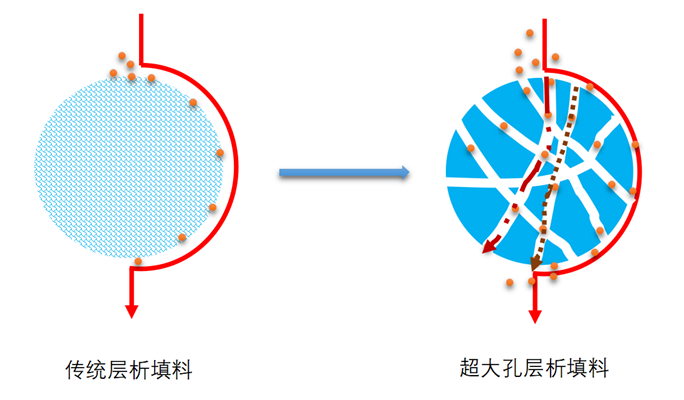
由于传统的填料固定相内部只有狭窄的扩散孔,因而其内部传质阻力较大,层析柱压降较大,对于生物大分子的传质速率、分离效率和结构保持都比较低:而定制化大孔填料中对流孔的存在可有效地克服传统填料的上述缺点,孔内对流传质大幅削弱了扩散传质速度慢的影响。
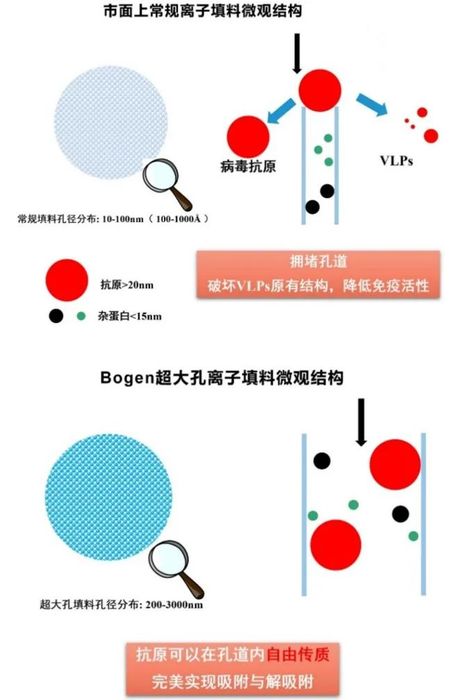
IgM分子、蛋白三聚体、新型VLP疫苗和各种基因病毒载体这些生物大分子的分子量大,分子尺寸能达到纳米级,而常规多孔微球填料的孔道较小,生物大分子进出填料的阻力增大、分离时间增长,致使层析柱的分离性能明显降低。同时,会使生物大分子的三级、四级结构变化,造成蛋白质药物质量和收率的下降。在定制化大孔内由于流动相流速快,分离速度快,使生物大分子与介质界面的相互作用时间大幅度减少,同时暴露在不稳定环境中的时间短,可大幅度减少蛋白质的失活,有效提高生物大分子的活性回收率和产率。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多