化学药品的专利类型及专利布局点
那么,化合物专利到底具有怎样的存在?笔者根据自身新药项目开发的基础,以及专利申请-授权的经验,总结此文,以期共同进步。
创新药,最早的选题立项,通常可从两个方面出发,一个是疾病,一个是靶点。在综合二者之后,会形成一个针对目标适应症及确切靶点的药物研发计划,讨论通过之后,新药项目即可进入到发现阶段。
对于一个靶点,通过对化合物结构现有技术总结,制定化合物结构优化策略,并随着药效、类药性、成药性的不断深入,逐渐确定相应的Hit和Lead,通过数据的综合分析,通常会有2~3个备选的lead进入到新药开发阶段。
进入开发阶段,可再划分为2个阶段,即临床前&临床。临床前,会在药学CMC的基础上进行非临床开发,具体有药效、药代、毒理试验,以及一些建议进行的非临床试验;在安全性初步确定没有问题的前提下,即可着手临床试验的申请。拿到临床默示许可后,相继进入临床的I~III期,如幸运,拿到足够的安全性、有效性数据,经监管部门审评,方可获得批准上市,进入到新药研发的商业收获期。
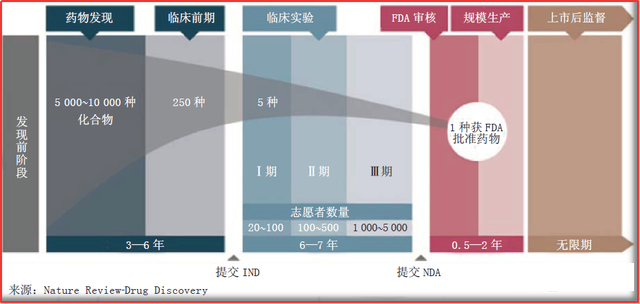
图1.1 创新药的研发周期特点(图片源:《药学进展》)
通过上述对创新药研发体系的梳理,可以看出,创新药的整个研发生命周期极长!这也印证了医药行业对于创新药研发特点的总结:长周期、高风险、高回报。但是,这不代表长周期、高风险,就一定能换来高回报、乃至高附加值。这个高回报,就必须需要知识产权在全生命周期中的层层防守层层筑垒。
如何防守?如何筑垒?为了详细说明,这里需要对创新药的专利布局进行解释。
从专利的角度来说,专利保护通常是指对产品的保护,或是对方法的保护;对于药品专利来说,也可以分为产品专利如化合物、前药、晶体、盐、溶剂合物、异构体、中间体、制剂、包装等,以及方法专利如药品使用方法(适应症,也可以归属为“用途”专利)、制备方法、活性检测或筛选方法、中间体的制备方法等。

图2.1 药品专利概况
但对于行业来说,还可以从专利重要程度进行分类,即核心专利和外围专利。核心专利,通常指的是原研企业在研制新药过程中取得的首创性的发明创造,是整个专利保护体系的核心,一般情况具体为化合物、光学异构体、晶型、制剂、用途专利。外围专利,是指在核心专利的基础上,外围布局的防御性专利,以阻止与原研相似的跟随性创新,一般情况具体为化合物外围的马库士化合物、前药、代谢物产物、新晶型、盐型专、组合物专利等,围绕核心专利构建出严密健全的专利保护体系。
通过上述对药物专利的介绍,不难看出,不论以何种方法进行归类,化合物专利,是具商品属性药物的绝对核心专利、核心知识产权!如,阿哌沙班,近年来小分子药物全球销售额前三品种,其专利布局网络及其庞大,概况可见下图。
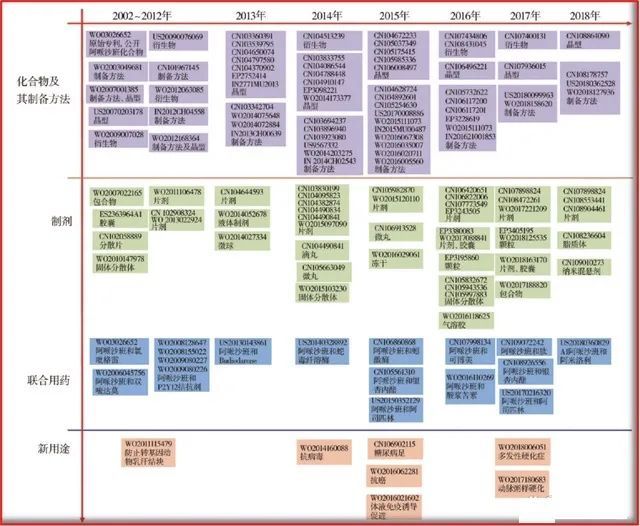
图2.2 阿哌沙班专利布局图(图片源:CNKI)
化合物专利通常是大家关注的重中之重,包括通式化合物、药学上可接受的盐、活性代谢产物、前药、手性药物/光学异构体、中间体、衍生物、药物杂质等。
也称为基础化合物,该类化合物的专利仅指化合物核心结构的专利,通常称为核心专利,其不包括以酸根、碱基、金属元素、结晶形式等结构改变实施保护的化合物专利。
化合物核心专利的特点是技术含量高、其权利要求保护的范围宽、对真正目标化合物的隐蔽性强。通式化合物专利一旦获得授权,则是对化学物质或药物活性分子( API) 的绝对保护,通常难以规避,针对 API 的权利要求一般也很难被专利无效掉。
很多化合物作为药物,最后上市的都是盐型,如马来酸桂哌齐特、盐酸帕罗西汀、二甲苯磺酸拉帕替尼等。化合物的盐可在某种程度上改善药物本身的物理溶解性,提高药物的生物利用度。由通式化合物本身出发,在其基础上进行的化合物盐的二次创新,间接延长了具体药物的专利保护期。
例如辉瑞公司曾经最畅销的降血脂药立普妥( 阿托伐他汀) ,其于1986 年5月30日申请的美国专利 US4681893,保护了含有阿托伐他汀的通式化合物及其药学上可接受的内酯水解盐,其申请的后续专利 US5273995 则保护了阿托伐他汀及其钙盐( 即阿托伐他汀钙) ,'893 和 '995 分别都通过儿科用药( pediatric medication,PED) 6 个月的市场独占期规定,获得专利期延长半年,其过期日分别为 2010 年 3 月 24 日、2011 年 6 月 28 日,这两个重要的专利使得该药物的专利保护期延长了 5 年。
在进行化合物的药物代谢动力学研究时,可能会意外发现, 某 1 种或几种代谢产物比药物本身的活性更强。因此可以对活性代谢产物进行专利布局,并进一步将代谢产物开发成新一代的药物,以取代原化合物的市场。
例如辉瑞( 原惠氏) 原研的抗抑郁药盐酸文拉法辛( 商品名: 怡诺思) ,其于 1993 年12月28日在美国批准上市,化合物专利已于2008 年过期。而为了对抗通用名药的激烈竞争, 以及填补怡诺思专利到期后可能出现的市场空缺, 惠氏公司特意推出琥珀酸去甲文拉法辛( 商品名: Pristiq) ,并于 2008 年2月29 日获得 FDA 批准。去甲文拉法辛是文拉法辛的活性代谢产物,其抗抑郁的效果与文拉法辛相似,但可明显降低因药物相互作用引起的风 险。该药物的化 合物专利 US6673838 于2022年2月11日才到期,相当于是将原产品的专利保护期延长了 14 年。
也称前体药物、药物前体、前驱药物等,是指药物经过化学结构修饰后得到的在体外无活性或活性较小、在体内经酶或非酶的转化释放出活性药物而发挥药效的化合物。
例如吉利德公司成功开发并上市 的新型核苷酸类逆转录酶抑制剂替诺福韦酯,即是替诺福韦的前药形式。
在进行手性药物开发时需要考虑,光学异构体是否比消旋体的药效更好,或者光学异构体相对于消旋体有明显的增效作用? 是否有涉及毒性的异构体? 在实际的研发过程中,可能会发现起药效作用的活性异构体; 或者通过异构体转化方法,将无活性异构体转化成活性异构体,那么此时可以申请布局在基本专利中没有具体提及或者描述的、具有不可预见的优点的、更具活性的异构体化合物专利。
例如目前畅销的抗血栓药硫酸氢氯吡格雷( 商品名: 波立维),其左旋异构体在50 mg/kg的给药剂量时会产生明显的神经毒性,但是右旋异构体无神经毒性,因此上市的是右旋异构体。
医药中间体主要作为精细化工的重要组成部分,逐渐成为各国发展化学工业的重点与核心,最终临床使用的合格药品,都是依赖于各类高质量的医药中间体合成出来的。发展新的医药中间体、以及现有医药中间体的制备方法专利,是对现有医药专利形式的有益补充。
主要涉及对化合物、中药单体等的结构改造、氘代等。例如,已上市的氨苄西林、苯唑西林、阿莫西林等均为青霉素衍生物。贝达药业上市的治疗肺癌的国家1类新药盐酸埃克替尼( 化合物专利 CN1305860C),即是在对厄洛替尼进行结构改造,并突破厄洛替尼化合物专利( CN1066142C) 而 得到的。
药物研发特别是非专利药研发过程中,对药物杂质谱的关注日益增强,企业可以布局一些药物杂质合成、分析及定量、限量检测方面的专利。
晶型是药物保护的最常见形式,通常在开发出基础化合物后,申请人会陆续申请晶型专利,扩展并加强对基础化合物的保护。化学结构相同的药物,可因结晶条件不同而得到不同晶体,药物多晶型现象也是影响药品质量与临床药效的重要因素之一。
药物优良的晶型可提高 API 的热力学稳定性、提高制剂稳定性,好的晶体有利于制剂成型; 通过结晶可提高 API 的纯度,提高溶解度、增加生物利用度、提升药效。因此在实际研发工作中,对药物晶型的专利保护包括但不限于单晶、多晶、共晶、结晶水合物、溶剂化物、无定形固体、颗粒的粒度等。
制剂专利涉及的方面有制剂开发、制剂生产工艺改进、制剂升级等。在制剂研究中,综合考虑化合物的各种性质基础上,开发出最合理的产品剂型( 如普通剂型的片剂、胶囊、颗粒、注射液等) 、制剂工艺( 如干法制粒、湿法制粒、粉末直接压片) 以及车间生产工艺改进等。另外,制剂开发还涉及新剂型,药物通常是先以标准的片剂、胶囊或者注射剂形式上市,但是,随着药物核心专利失效日的来临,药物的研发公司会寻求开发出新的剂型以满足不同的市场范围和不同患者人群的需求。
对现有药物进行的剂型改良,如由普通剂型转变为高端剂型如缓控释制剂、皮下植入剂、纳米混悬剂等,然后针对新剂型进行工 艺的二次开发,并申请专利,可有效拓展现有药物的使用范围,延长专利保护期。
例如 GSK 的原研药盐酸罗匹尼罗,其在片剂专利期满后的 2008 年推出罗匹尼罗缓释片,继续占领帕金森病药物市场,而盐酸罗匹尼罗缓释片在中国的授权专利 CN1198598 将于 2021 年 4 月才到期。
药物组合物包括:
① 含有 1 种新化合物和可药用载体的组合物。
② 含有 1 种药用新化合物和 一种或多种已知的药用化合物的组合物。
③ 含有 2 种或 2 种以上已知药用化合物的组合物,该组合物必须是新的,且有药效学比较数据证明该药物组合物中 2 种或 2 种以上组分具有明显的协同作用。
例如吉利德公司治疗丙肝的复方制剂 Harvoni 。其中索非布韦( sofosbuvir) 是迄今为止最为高效的丙肝治疗药物之一,2013 年12 月被 FDA 批准上市,2014 年全年销售额达到了惊人的 102.8 亿美元。2014 年1月,吉利德布局专利 WO2014120981 ( 同族 CN104144682) ,要求保护含有治疗有效量的雷迪帕韦和治疗有效量的索非布韦的药物组合物,该专利对应的复方药物索非布韦/雷迪帕韦片( 商品名: Harvoni) 也于2014年10月10日获美国 FDA 批准上市,该复方制剂在随后 的 2个月内销售额就达到了 20亿美元,这是一个很经典的药物组合物案例。
制备方法专利涉及对化合物、晶型、制剂等产品的化学或生物制备新方法、新路线,精制或纯化方法、制剂工艺等。此外,药物中间体的制备专利保护对方法专利有很好的加强作用,杂质的制备与分离专利对药物的 API、质量分析也是一个很好的补 充。
制备方法专利应该具备以下创新点或者有益效果: 提高产率,改善质量,节约能源,防治了环境污染,避免使用毒性试剂和溶剂,使用非复杂和非昂贵的起始物料,容易分离和提纯最终产物,容易按比例 扩大生产规模等。但是方法类专利的弊端在于: 就 算发现被侵权,也比较难举证。所以有时候,国外药企会把一些核心的工艺方法、精制方法专利按照技术秘密保护,而不是进行专利形式的保护。
药物及其中间体、制剂等的分析方法、检测方法是用科学手段解决了“如何检验出药品中是否含有某种成分或成分含量多少的问题”,是在专利授权范畴内的。分析检测方法专利能否得到授权,最重要的还是要体现出该方法满足专利授权的三性条件。
2016 年3 月CFDA 发布《化学药品注册分类改革工作方案的公告》( 2016 年第 51 号) 中的药品新注册分类“2.4 类”药物为含有已知活性成份的新适应症的制剂。其具有的优势为: 成药性高、研发经费低、有广阔的知识产权空间。
例如辉瑞公司最开始研制用于治疗冠心病的药物西地那非( sildenafil) ,在1991年实验发现对冠心病的治疗效用不能达到研究预期,但是在临床试验中陆续发现了其用于治疗勃起功能障碍( CN94192386X) 、肺动脉高压( EP1097711) 的新用途,相继于1998 年、2005 年经FDA 批准并应用于临床至今。
关于这个方向,有一个很典型的例子是治疗阿尔兹海默病的药物多奈哌齐,由日本卫材公司原研,最开始临床应用的剂量是 5 和 10 mg,分别用来治疗 轻、中度阿尔兹海默病,后来卫材公司申请了23 mg 高剂量多奈哌齐用于治疗重度阿尔兹海默病患者 ( US8481565B2) ,并成功获得 FDA 批准。这样,卫材公司的多奈哌齐成为了目前综合治疗轻、中、重度阿尔兹海默病的理想药物。
在评价此类专利创造性的时候,可以有针对性的进行发明专利、或实用新型专利的申请。对于同一个主题的专利申请,如该专利具备较高的创造性,则我们可同时提交发明专利和实用新型专利申请,实用新型专利一般不经过实审,会在大约半年后得到授权,获得10 年的实用新型专利保护,而发明专利会经过实审程序,如发明也具备授权条件,则我们 需放弃实用新型的权利,转变成 20 年的发明专利保护,即延长了 10 年的专利保护期。
综上所述,通过在研发阶段即有节奏、有针对性地对该药物进行专利的布局,从而为该产品上市后赢得一定的市场份额提供技术保障。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多