正常情况下,AHR存在于细胞质中,与多种伴侣蛋白形成复合物。但AHR在与配体结合后,会通过核孔进入细胞核内并与芳香烃受体核转位因子(Aryl Hydrocarbon Receptor Nuclear Translocator, ARNT)形成二聚体。形成的二聚体可以与DNA中的异源响应元件(Xenobiotic response element,XRE)结合,促进下游基因表达。AHR在核内同时也能与其他转录因子结合,从而影响受到结合的转录因子调控的基因的表达。
在AHR信号通路调控的蛋白中,细胞色素P450超家族(cytochrome P450)是研究得最透彻的。AHR的激活可以直接引发CYP1A1、CYP1A2等蛋白的表达,而这些酶对芳香族化合物的代谢起着至关重要的作用:不仅负责外源性毒性物质的代谢,也会影响多种药物的生物代谢。不仅如此,近来研究还发现,AHR信号通路对维持免疫系统平衡有着重要的意义。
最早发现的AHR配体属于多环芳烃化合物(polycyclic aromatic hydrocarbons)及其衍生物,其中四氯二苯并-p-二恶英(2,3,7,8-tetracholrodibenzo-p-dioxin, TCDD)是目前效价最强的AHR激动剂之一。这类物质一般来源于生物体外部,长期摄入会造成毒性反应,带来组织损伤且具有高度致癌性。
然而在小鼠的急性移植物抗宿主病(acute graft-vs-host disease)模型中,短期TCDD处理能够产生具有免疫抑制能力的类Treg细胞亚群,这个现象是依赖于AHR的表达。
在小鼠感染流感病毒的模型中,TCDD处理激活AHR通路后降低了具有细胞杀伤功能的CD8+ T细胞反应,导致CD8+ T细胞的表观遗传学谱与基因表达谱发生类似耗竭CD8+ T细胞的变化。在一个小鼠系统性红斑狼疮的模型中,TCDD处理降低了白蛋白尿、血清中抗DNA抗体及总IgG抗体浓度,整体减轻了自身免疫症状并降低了死亡率。
除了外源激动剂外,研究人员还发现AHR有许多内源性激动剂。
其中,必需氨基酸之一的色氨酸可以通过吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)以及色氨酸2,3-双加氧酶(tryptophan 2,3-dioxygenase,TDO)生成犬尿氨酸(kynurenine),犬尿氨酸本身就有一定的AHR激动剂活性,同时犬尿氨酸还会进一步代谢成犬尿喹啉酸(kynurenic acid)、黄尿酸(xanthurenic acid)等具有更强效价的AHR激动剂。
另外,色氨酸还可以通过氧化反应生成效价非常强的AHR激动剂ITE(2-(1’H-indole-3’-carbonyl)-thiazole-4-carboxylic acid methyl ester),或者通过UV光照生成FICZ(6-formylindolo[3,2-b]carbazole)。
从白塞氏综合征(Behçet’s disease)病人血液中搜集的单核来源树突状细胞经过ITE或FICZ处理后会下调共刺激分子表达,降低脂多糖引发的炎症因子(如IL-6,TNF-a等)的分泌。
然而在小鼠的实验性变态反应性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型中,FICZ处理激活AHR后导致了分泌白介素22的TH17细胞的增殖以及白介素22分泌的增加,最终加重了病变。
有趣的是,在EAE模型中,TCDD的处理会激活Treg细胞的免疫抑制作用,从而对病变起到保护性作用。这说明不同AHR激动剂在特定条件下可能体现出不同的生物学反应,增加了研究的复杂性,但同时也扩展了AHR信号通路免疫调节的可能性。
生物体内还有一个重要的AHR激动剂来源:共生菌群。
大肠杆菌(Escherichia coli)产生的色氨酸酶(tryptophanase)可以将食物来源的色氨酸分解成吲哚类物质,然后在肝内被转化成AHR的激动剂硫酸-3-吲哚酚(indoxyl-3-sulfate, I3S)。
而滋养节杆菌(Arthrobacter pascens)、梭状芽孢杆菌(Clostridium sporogenes)及罗伊氏乳杆菌(Lactobacillus reuteri)等可以将色氨酸转化成吲哚-3-乙酸(indole-3-acetic acid, IAA)、吲哚-3-甲醛(indole-3- aldehyde, I3A)等AHR激动剂。肠道内菌群产生的I3A能够通过激活AHR使肠内黏膜3型先天淋巴样细胞(type 3 innate lymphoid cells)分泌白介素22,维持肠内菌群平衡。
除此之外,食物尤其是十字花科植物来源的硫代葡萄糖苷(glucosinolates)会水解成吲哚-3-甲醇(indole-3-carbinol, I3C)及吲哚并[3,2-b]咔唑(indolo[3,4-b] carbazole, ICZ)等AHR激动剂。
这些激动剂对AHR信号通路的激活对维持小肠上皮内淋巴细胞(intraepithelial lymphocytes, IELs)的稳定有着重要作用,从而维持上皮细胞的增殖,控制炎症反应。在硫酸葡聚糖钠盐(dextran-sodium-sulfate)引发的结肠炎模型中,食物来源激动剂对AHR的激活可以减轻炎症,降低病变严重程度。
AHR作为细胞感知外界环境的一个感受器,在屏障细胞及部分免疫细胞中都有高表达,而AHR信号通路在免疫系统调节过程中也被证明是一个关键的信号通路。AHR激动剂已经在一些代表性的自身免疫疾病模型中(包括系统性红斑狼疮、白塞氏综合征、多样性硬化、炎性肠病等)显示出作用。
同时由于AHR激动剂的多样性以及不同激动剂产生的不同效应,为靶向激活AHR信号通路的药物设计带来更多的可能性。
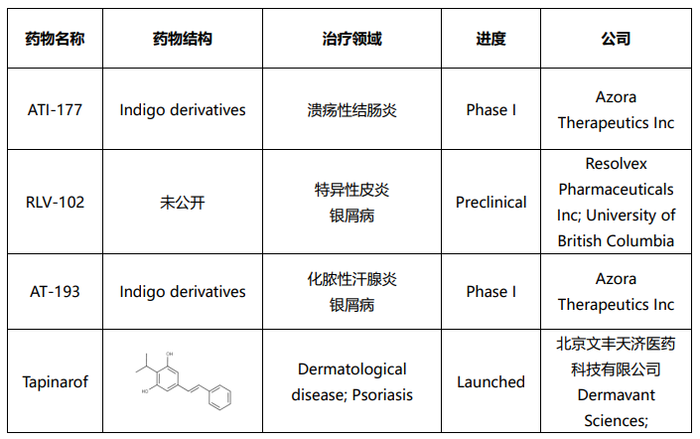
Dermavant Sciences公司针对银屑病的药物tapinarof已经被FDA批准上市。Azora Therapeutics公司针对溃疡性结肠炎的药物ATI-177以及针对化脓性汗腺炎与银屑病的药物AT-193已经进入临床I期,Resolvex Pharmaceuticals公司针对特异性皮炎和银屑病的药物RLV-102也处于临床前的阶段。
我们期待未来可以有更多靶向AHR的免疫调节类药物成功问世。
[1] Shinde, R. & McGaha, T. L. The Aryl Hydrocarbon Receptor: Connecting Immunity to the Microenvironment. Trends. Immnunol. 39:1005-1020. 2018.
[2] Quintana, F. J. et al. Control of T(reg) and T(H)17 cell differentiation by the aryl hydrocarbon receptor. Nature. 453:65-71. 2008.
[3] Schiering, C. et al. Feedback control of AHR signaling regulates intestinal immunity. Nature. 542:242-245. 2017.
[4] Li, Y. et al. Exogeneous stimuli maintain intraepithelial lymphocytes via aryl hydrocarbon receptor activation. Cell. 147:629-640. 2011.
来源:药渡















评论
加载更多