挑战不可成药靶蛋白:创新类药物分子胶
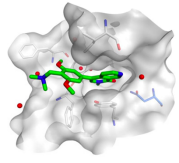

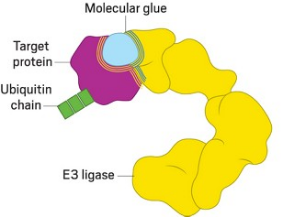
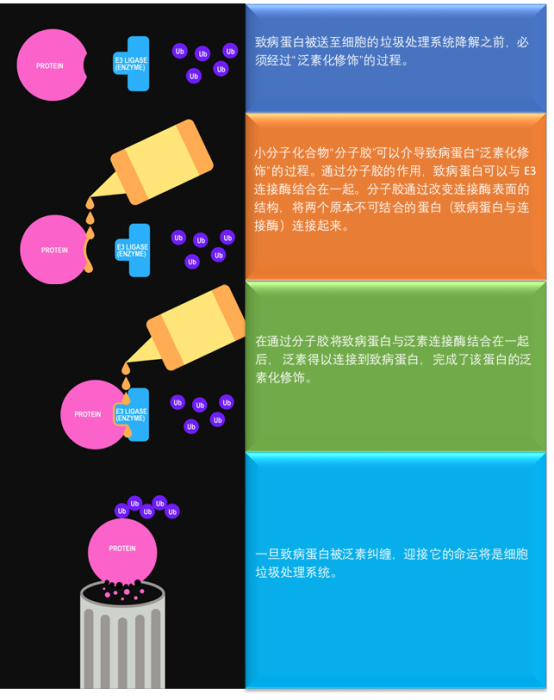 图
2
.
分
子胶作用机制图示。(图片来源:自
Pf
izer
改编)
图
2
.
分
子胶作用机制图示。(图片来源:自
Pf
izer
改编)
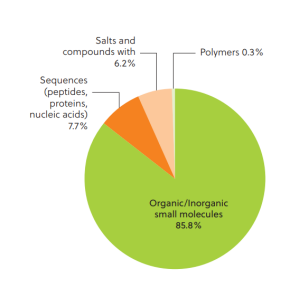

分子胶介导蛋白质降解以及疾病治疗案例
|
|
|
靶蛋白 |
|
|
|
|
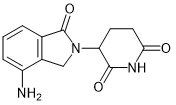
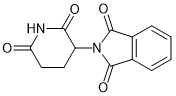
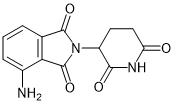
IKZF1, IKZF3 |
多发性骨髓瘤, 骨髓增生异常综合症(MDS), 5号染色体长臂缺失症候群 |
Thalidomide (沙利度胺) |
|
|
|
|
|
|
IKZF1, IKZF3 |
|
分子胶名称 |
化学结构 |
靶蛋白 |
疾病 |
CR8 |
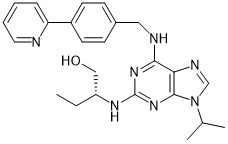
|
Cyclin K |
癌症 |
Glue01 |
|
Cyclin K |
癌症 |
HQ005 |
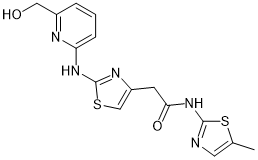
|
Cyclin K |

酪蛋白激酶 1α (CK1α) 降解分子胶
分子胶名称 |
化学结构 |
靶蛋白 |
疾病 |
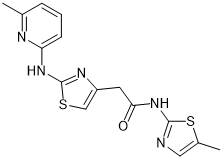
FPFT-2216 |
|
IKZF1, CK1α |
多发性骨髓瘤 |
TMX-4116 |
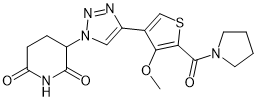
|
CK1α |
多发性骨髓瘤 |

G1-S 相变蛋白 1 (GSPT1) 降解分子胶
分子胶名称 |
化学结构 |
靶蛋白 |
疾病 |
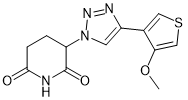
Eragidomide |
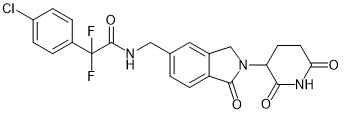
|
GSPT1, eRF3a |
急性髓系白血病 |
ZXH-1-161 |
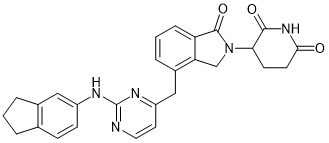
|
GSPT1, GSPT2 |
多发性骨髓瘤 |

RNA 结合基序蛋白 39 (RBM39) 降解分子胶
分子胶名称 |
化学结构 |
靶蛋白 |
疾病 |
Indisulam (吲哚美辛) |
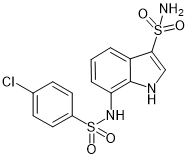
|
RNF39, RBM39, RBM23 |
白血病 |
E7820 |
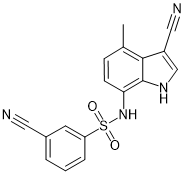
|
RBM39, RMB23 |
大肠直肠癌 |
CQS |
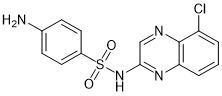
|
RBM39, RMB23 |
肺癌,大肠直肠癌 |

天然分子胶
虽然分子胶大多是在实验室中设计合成的,但自然界中也存在分子胶化合物。环孢菌素 A [Cyclosporin A, CsA (表 6)] 是结合亲环蛋白 18 (Cyp18)的分子胶,所形成的Cyp18-CsA 复合物再与依赖钙/钙结合蛋白的钙调磷酸酶作用,抑制NF-AT的去磷酸化使其不能进入核内,从而抑制IL-2的产生,T淋巴细胞的生成受抑制。7CsA 是一种高度特异性的 T 细胞活化抑制剂。从20世纪80年代CsA作为免疫抑制剂用于临床以来,在器官移植治疗中发挥了重大作用,奠定并推动了器官移植的发展。全世界已有超过20万例的患者使用环孢菌素A作为器官移植时的抗排斥反应药物。作为免疫抑制剂它还被应用于一些自身免疫性疾病的治疗,如对类风湿关节炎及白塞,对I型糖尿病、牛皮癣和寄生虫病如疟疾、血吸虫等有一定疗效。此外,环孢菌素A还具有广泛的其它生物学活性如抗真菌、抗寄生虫、抗HIV、抗炎、逆转肿瘤细胞多药耐药等作用。
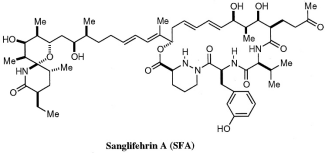
Voclosporin (Lupkynis) 已获FDA批准用于治疗成人狼疮性肾炎。Voclosporin是新型免疫调节药物,抑制钙调神经磷酸酶,其作用机理与CsA相似。8Sanglifehrin A (SfA) 表现出抗增殖和免疫抑制作用,它通过抑制 T 细胞和 B 细胞增殖发挥活性。SfA充当Cyp18 和肌苷5'-单磷酸脱氢酶2 (IMPDH2)的分子胶。9植物激素生长素 (AUX、吲哚-3-乙酸、IAA)和茉莉酮酸( jasmonate)都是结构简单的天然分子胶化合物。植物激素生长素直接与 Skp1-cullin 1-F 盒蛋白(SCF) E3 泛素蛋白连接酶 TIR1结合,引发AUX蛋白的降解。茉莉酮酸利用 E3泛素连接酶 SCFTIR1 吸引和降解茉莉酸-ZIM (JAZ) 结构域蛋白。10
分子胶名称 |
化学结构 |
靶蛋白 |
疾病 |
Cyclosporin A (环孢菌素 A) |
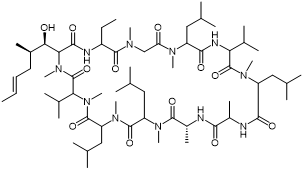
|
Cyclophin-1受体 |
|
Lupkynis (伏环孢素) |
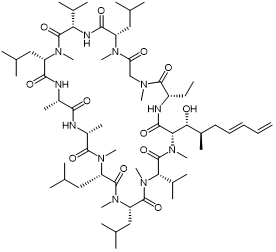
|
钙调神经磷酸酶 |
狼疮性肾炎 |
Sanglifehrin A |
|
IMPDH2 |
癌症 |
Auxin |
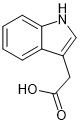
|
AUX/IAA transcriptional regulator |
|
茉莉酮酸 |
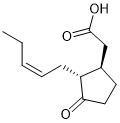
|
茉莉酮酸zim 结构域蛋白 |

总结
[1] Janet M. Sasso ,Rumiana Tenchov, DaSheng Wang, Linda S. Johnson, Xinmei Wang, Qiongqiong Angela Zhou. Molecular Glues: The Adhesive Connecting Targeted Protein Degradation to the Clinic. 2022. ASAP. https://doi.org/10.1021/acs.biochem.2c00245
[2] Chamberlain, P. P.; Lopez-Girona, A.; Miller, K.; Carmel, G.; Pagarigan, B.; Chie-Leon, B.; Rychak, E.; Corral, L. G.; Ren, Y. J.; Wang, M.; Riley, M.; Delker, S. L.; Ito, T.; Ando, H.; Mori, T.; Hirano, Y.; Handa, H.; Hakoshima, T.; Daniel, T. O.; Cathers, B. E. Structure of the human Cereblon-DDB1-lenalidomide complex reveals basis for responsiveness to thalidomide analogs. Nature Structural & Molecular Biology. 2014, 21, 803−809.
[3] Słabicki, M.; Kozicka, Z.; Petzold, G.; Li, Y.-D.; Manojkumar, M.; Bunker, R. D.; Donovan, K. A.; Sievers, Q. L.; Koeppel, J.; Suchyta, D.; Sperling, A. S.; Fink, E. C.; Gasser, J. A.; Wang, L. R.; Corsello, S. M.; Sellar, R. S.; Jan, M.; Gillingham, D.; Scholl, C.; Fröhling, S.; Golub, T. R.; Fischer, E. S.; Thomä, N. H.; Ebert, B. L. The CDK inhibitor CR8 acts as a molecular glue degrader that depletes cyclin K. Nature. 2020, 585, 293−297.
[4] Teng, M.; Lu, W.; Donovan, K. A.; Sun, J.; Krupnick, N. M.; Nowak, R. P.; Li, Y.-D.; Sperling, A. S.; Zhang, T.; Ebert, B. L.; Fischer, E. S.; Gray, N. S. Development of PDE6D and CK1α Degraders through Chemical Derivatization of FPFT-2216. J. Med. Chem. 2022, 65, 747−756.
[5] Matyskiela, M. E.; Lu, G.; Ito, T.; Pagarigan, B.; Lu, C.-C.; Miller, K.; Fang, W.; Wang, N.-Y.; Nguyen, D.; Houston, J.; Carmel, G.; Tran, T.; Riley, M.; Nosaka, L. A.; Lander, G. C.; Gaidarova, S.; Xu, S.; Ruchelman, A. L.; Handa, H.; Carmichael, J.; Daniel, T. O.; Cathers, B. E.; Lopez-Girona, A.; Chamberlain, P. P. A novel cereblon modulator recruits GSPT1 to the CRL4CRBN ubiquitin ligase. Nature. 2016, 535, 252−257.
[6] Han, T.; Goralski, M.; Gaskill, N.; Capota, E.; Kim, J.; Ting, T. C.; Xie, Y.; Williams, N. S.; Nijhawan, D. Anticancer sulfonamides target splicing by inducing RBM39 degradation via recruitment to DCAF15. Science. 2017, 356, No. eaal3755.
[7] Matsuda, S.; Koyasu, S. Mechanisms of action of cyclosporine. Immunopharmacology. 2000, 47, 119−25.
[8] Guo, Z.; Hong, S. Y.; Wang, J.; Rehan, S.; Liu, W.; Peng, H.; Das, M.; Li, W.; Bhat, S.; Peiffer, B.; Ullman, B. R.; Tse, C.-M.; Tarmakova, Z.; Schiene-Fischer, C.; Fischer, G.; Coe, I.; Paavilainen, V. O.; Sun, Z.; Liu, J. O. Rapamycin-inspired macrocycles with new target specificity. Nat. Chem. 2019, 11, 254−263.
[9] Sanglier, J. J.; Quesniaux, V.; Fehr, T.; Hofmann, H.; Mahnke, M.; Memmert, K.; Schuler, W.; Zenke, G.; Gschwind, L.; Maurer, C.; Schilling, W. Sanglifehrins A, B, C and D, novel cyclophilin-binding compounds isolated from Streptomyces sp. A92−308110. I. Taxonomy, fermentation, isolation and biological activity. J. Antibiot. 1999, 52, 466−73.
[10] Chini, A.; Fonseca, S.; Fernández, G.; Adie, B.; Chico, J. M.; Lorenzo, O.; García-Casado, G.; López-Vidriero, I.; Lozano, F. M.; Ponce, M. R.; Micol, J. L.; Solano, R. The JAZ. family of repressors is the missing link in jasmonate signalling. Nature. 2007, 448, 666−671.
[11] Santos, R.; Ursu, O.; Gaulton, A.; Bento, A. P.; Donadi, R. S.; Bologa, C. G.; Karlsson, A.; Al-Lazikani, B.; Hersey, A.; Oprea, T. I.; Overington, J. P. A comprehensive map of molecular drug targets. Nat. Rev. Drug Discovery. 2017, 16, 19−34.
来源:E药学苑
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多