生物反应器规模放大的基本原理

Part
1
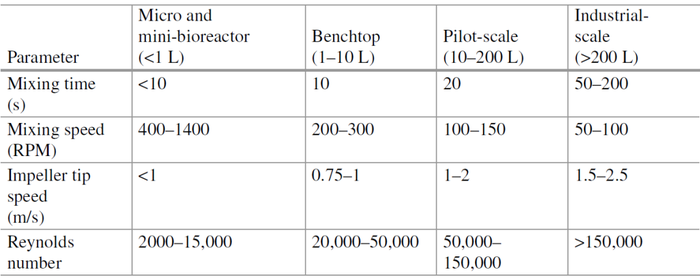
几何相似性通常是用于放大生物反应器的第一个标准。如果罐直径增加,所有其它长度(罐高度、叶轮直径和叶轮宽度)都会增加相同的比例因子。一般来说,用于细胞培养的生物反应器罐的高径比 (H/D) 对于台式生物反应器为 1-2,对于中试和工业规模的生物反应器为 2-3。然而,保持 H/D 会影响与表面和体积相关的因素,例如热传递、气体传递和混合。由于在罐壁上发生热交换,每单位体积的热传递随着体积的增加而减少。恒定的 H/D 纵横比也将显著降低表面积与体积比 (Ac/V),从而降低表面通气对O2和CO2汽提的贡献。因为气体传输速率的重要性以及对混合速度和气体流速的限制,这对于剪切敏感细胞至关重要。
Part
2

在剪切敏感细胞的情况下,可以使用恒定的叶轮叶尖速度;然而,体积功率的降低必须通过更高的气体流速来补偿,以保持可接受的氧气传输率,这也可能导致细胞损伤。此外,保持恒定叶轮叶尖速度所需的较低混合速度将导致大规模条件下混合较差。因此,叶轮叶尖速度可能不是生产体积差异较大时的合适放大标准。放大期间恒定的混合时间将导致叶轮叶尖速度增加,这可能导致细胞损坏,以及功率的极大增加。氧气传输、混合和适当的 CO2 汽提通常被认为是生物反应器放大过程中最重要的因素。因此,对于 CHO 细胞生物反应器培养的放大,最常选择对气体传输和混合的影响最小化的标准。
Part
3

Part
4
1
恒定氧传质系数 (KLa)
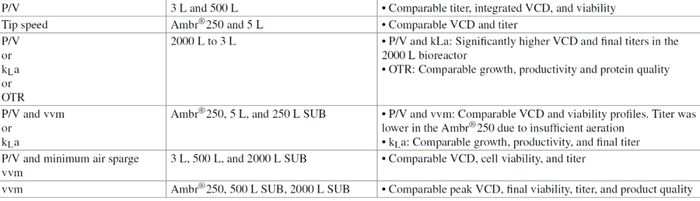
在 CHO 细胞培养中,保持适当的氧气传输至关重要,尤其是当生物反应器在高细胞密度下运行时。因此,在规模放大/缩小期间保持恒定 kLa 也是工艺开发中的常用策略。在将 Ambr®250 用作 5 L 实验室规模和 250 L SUB 系统的规模缩小模型时,其已被成功地用作标准。2-3 h-1的 kLa 满足规模缩小模型中的氧气需求,并导致 13 种 GS-CHO 和 DG44-CHO 细胞系中的 11 种具有可比的生长、生产力和最终产物滴度。通过气体流速和搅拌速度调整保持恒定的kLa (7.9 h-1) 也被证明可以在 50 L 到 2,000 L 的一次性生物反应器中产生类似的生长曲线。然而,生产规模的变化可能需要使用不同类型的气体鼓泡,从而使类似工艺条件的实现更加复杂。为了从配备钻孔鼓泡的 2,000 L 容器缩小到使用恒定 kLa 的 3 L 生物反应器,Tescione 等人不得不采用小规模的熔块鼓泡,以避免混合速度过快或气体流速过高,这已被证明对培养性能有害。但与大规模工艺相比,改变鼓泡类型会导致不同的细胞生长和代谢。
2
每体积的恒定体积气体流速 (vvm)
恒定最小通气 vvm 和等效 P/V 已被组合用作规模放大标准,以确保细胞生长、气体传输和 mAb 生产率在 3 L、500 L 和 2,000 L SUB 的各种规模上均匹配。选择最小空气流速以实现适当的 CO2汽提。在另一项研究中,使用恒定 P/V 和 vvm 作为使用 Ambr®250 创建规模缩小模型的标准导致 DO 水平较低 (<5%),并且无法模拟大规模的性能。这归因于小规模的较低气体停留时间和随之而来的氧气传递系数的降低。在生物反应器放大过程中要考虑的另一个重要因素是气体入口速度的影响。这在工业规模的生物反应器中尤其值得关注,其需要更高的气体流速来供应氧气并确保适当的CO2汽提。高气体入口速度 (>60 m/s) 被认为对培养性能有害,因为在鼓泡区域中湍流能量转移急剧增加。此外,高喷射率已被证明会引发氧化应激反应,并且还与氨基酸消耗的增加有关,以恢复氧化还原平衡。入口速度小于 20 m/s,在某些情况下高达 50 m/s,在小型到大型生物反应器中不会造成明显的细胞损伤。
Part
5
本文为以下文献内容简介,详细内容,请参考原文。
本文来源于“生物工艺与技术”平台
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多