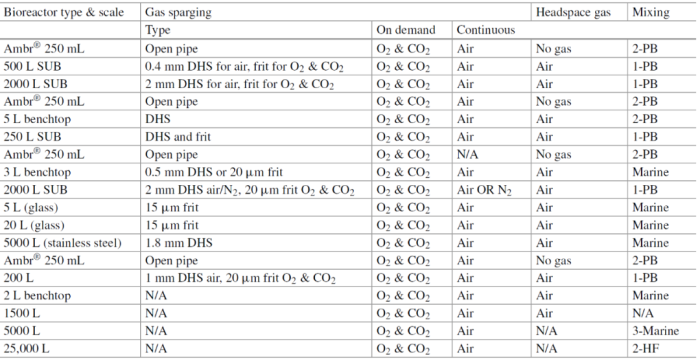
CHO细胞培养中,受规模放大影响的关键工艺条件
通气
在哺乳动物细胞生物反应器中,通气是一个关键组成部分,特别是在高细胞密度下操作时,因为需要向细胞提供足够的氧气,同时必须去除二氧化碳,以防止其在培养液中积累。这通常使用气体鼓泡和顶空通气的组合来实现。在大型容器中,氧气通过使用气体鼓泡分散在底部附近来提供。生物反应器中使用的气体扩散器可以是多孔熔块鼓泡(由陶瓷、聚四氟乙烯或不锈钢制成)或钻孔鼓泡 (DHS)。前者会产生较小的气泡,从而增加界面表面积和气体停留量,但也更容易引起泡沫,对 CO2 汽提效果不佳。因此,经常遇到双鼓泡设计。下表概述了常用的不同设计和通气配置。在大多数情况下,O2和CO2按需通入,以控制溶氧水平和 pH 值,而空气则不断通入,有时还供应到顶部空间。
哺乳动物细胞培养中的常见通气策略
氧气
在 CHO 细胞培养中,溶氧水平通常保持在空气饱和度的 10% 到 80% 之间。过高的氧浓度会导致活性氧 (ROS) 的积累,这会导致线粒体呼吸链和细胞内氧化还原的改变,最终导致细胞生长抑制和特异性生产力下降。另一方面,低氧条件也会诱导 ROS 积累。研究已显示在 20% DO 下 10 天的长时间暴露会引起与在 0.5%–5% DO 下暴露 1-3 天后观察到的相同的缺氧反应。缺氧条件也与摄氧量减少和乳酸产量增加有关。ROS 积累与大规模(5,000 L)条件下生产力的显著下降相关,而在小规模(20 L)条件下没有遇到这种问题。因此,在规模放大过程中必须仔细选择 DO 设定点,尤其是由于静水压力效应;在类似的 DO 水平(空气饱和度%)下,与台式生物反应器相比,大型容器中的实际氧气浓度将显著更高。尽管表面通气减少了由气泡引起的剪切应力,但它对整体气体传输的贡献在更大的范围内变得可以忽略不计。为了减少由气泡在气液界面破裂引起的剪切应力,将表面活性剂,如Pluronic F-68(或 Kolliphor® P188),添加到细胞培养液中。1 g/L(和高达 5 g/L)范围内的Pluronic 浓度通常用于提供剪切保护。
氧气传质系数 (kLa) 用于衡量系统的氧气传输能力。对于给定的生物反应器配置,根据以下公式,kLa主要与单位体积功率输入 (P/V) 和表观气体速度 (vs) 相关,其中 K 是常数,指数 α和 β 分别约为 0.4 和0.5,
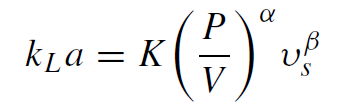
气泡大小、混合速度、气体流速、体积和生物反应器几何形状等工艺参数都会影响 kLa。各种培养基成分,包括盐、消泡剂和表面活性剂,也已被证明会影响传质系数。特别是,消泡剂被发现可以显著降低 kLa。Pluronic F-68 也会降低 kLa,但程度较小,而盐的添加会增加氧传质系数。另一个影响 kLa 的因素是叶轮的数量。与 3 叶轮配置相比,当在聚集抑制性培养基(例如大多数培养液)中保持单位体积功率和气体流速恒定时,使用单叶轮可以增加 kLa。这表明在形成气泡的地方集中能量输入会增加整体质量传递。一般来说,类似几何形状的生物反应器规模的增加将导致 kLa 的增加,正如在传统搅拌罐和一次性生物反应器中所指出的那样。液体高度的增加导致更长的气体停留时间,从而允许更有效的气体转移。
二氧化碳
在哺乳动物细胞培养中,溶解的二氧化碳 (pCO2) 水平通常保持在 4-10% 的CO2饱和度 (30-70 mmHg)。众所周知,高浓度的溶解CO2 (150–200 mmHg) 会对多种哺乳动物细胞的细胞生长和生产力产生不利影响。在 CHO 细胞培养中,高 pCO2 水平可抑制细胞生长、细胞生产力并改变产品质量。溶解在水中的CO2通过与水反应形成碳酸盐,其分解成碳酸,而引起酸化。培养液的酸化导致需在 pH 值控制的培养中添加碱,从而导致渗透压增加。与正常水平(260-320 mOsm/kg)相比,渗透压升高(460-500 mOsm/kg)会降低活细胞密度和活性。这在补料分批培养中进一步加剧,在这种情况下,浓缩营养物的补液可导致渗透压高达 540 mOsm/kg。尽管CO2可能对细胞培养性能产生不利影响,但它仍然是核酸代谢合成所必需的,因此其浓度不得过低。与正常 pCO2 水平(28-54 mmHg)相比,发现超低 pCO2 水平(12.5-24.5 mmHg)在细胞培养 6 天后会降低活细胞密度和细胞活性。
大规模动物细胞培养面临着以与消耗氧气大致相同的摩尔速率去除细胞产生的二氧化碳的问题。在大型容器中,顶空通气通常不足以去除二氧化碳。因此,必须调整鼓泡流速和搅拌速度,以确保有效的二氧化碳汽提。应该注意的是,据报道,二氧化碳汽提与大型生物反应器中的气体传质系数无关。相反,由于相对于气泡饱和时间较长的气体停留时间,二氧化碳会在培养基中积累;气泡在离开培养基之前变得二氧化碳饱和,使得传质不再限制二氧化碳汽提。
搅拌
搅拌不仅有助于确保均匀的条件,而且在改善传质方面也起着重要作用,这对于向细胞提供氧气和去除二氧化碳很重要。大规模哺乳动物细胞培养中的搅拌通常由轴向泵送叶轮提供,例如斜叶片或水翼叶轮。与 Rushton 叶轮等径向流叶轮相比,轴流叶轮可以减少混合时间,并使施加到细胞上的剪切应力降低。在大型生物反应器中,通常在罐的周围使用挡板以引起湍流。如果没有挡板,叶轮提供的循环能量不足以促进适当混合所需的湍流运动。没有挡板也会导致中心涡流的形成,这可能导致顶部空间和培养液之间的不受控制的气体转移。另一种增加流动湍流的策略是偏心安装叶轮轴。这主要用于挡板不方便应用的情况,例如一次性生物反应器。然而,已知使用偏心安装的叶轮需要大约两倍的功率输入才能实现与同心叶轮轴相同的混合时间。
搅拌与通过单位体积功率输入 (P/V) 进行的通气有关,如公式(1)所示。单位体积功率输入是一个重要的工程参数,通常用作规模放大的标准,以确保可比的培养同质性。单位体积功率输入可以测量或使用公式(2)计算,
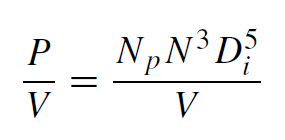
其中Np 为无量纲功率数,N 为混合速度,Di为叶轮直径,V 为体积。根据所使用的叶轮类型,可使用各种相关性来评估搅拌容器的功率数,通常与流态(雷诺数)和纵横比相关。当流动是湍流时,功率数变得独立于挡板容器中的雷诺数。
对于生物反应器中的 CHO 细胞培养,通常调整搅拌速度以获得 10–80 W/m3 范围内的 P/V。设置搅拌条件时必须考虑的另一个关键因素是叶轮叶尖速度。由于高叶轮叶尖速度(Vt) 会产生高剪切应力区域,因此将 Vt 降至最低是有利的。
在增加的空气或氧气喷射流速下,需要较低的搅拌速度以保持气体传质系数 (kLa) 恒定。这反过来又增加了混合时间,并可能在培养液中产生异质性,包括由不同的局部气体传质系数引起的显著溶氧梯度的存在。更大的容器中混合时间明显更长的事实可能会进一步加剧这种情况。例如,发现混合时间从台式 3 L 生物反应器的约 10 秒增加到工业规模生物反应器的约 120 秒。混合时间的增加会导致 pH、溶氧、二氧化碳和营养物浓度梯度。这些梯度可能会产生关键影响,因为细胞可能会经历非最佳操作条件区域(所谓的微环境),从而导致总体培养性能下降。特别是,已发现糖基化模式受到不同溶氧水平的影响。由于 pH 不均匀性,活细胞密度和产物滴度也受到负面影响。在生物反应器中,由于混合良好的区域和增加的静水压力,在靠近叶轮的底部发现了较高的气体传质系数。为了改善混合,Xing 等人建议尽量减少培养体积并在叶轮附近添加碱以尽量减少 pH 峰。
流体动力剪切应力
已知气体喷射是由剪切应力引起的细胞损伤的重要来源。对细胞的损害可能发生在气泡形成时、鼓泡处、叶轮-气泡相互作用时、气泡上升时以及液体表面气泡破裂期间。后者被发现是细胞损伤的主要来源。较小的气泡在表面破裂时由于更高的特异性能量耗散率而导致更多的细胞损伤。由于哺乳动物细胞对剪切力敏感,因此搅拌和通气速度必须保持在特定阈值以下。在减少搅拌和通气时,最重要的考虑是满足细胞的需氧量。因此,可以使用纯氧气,以在较低的气体流速下达到细胞的氧气需求,尽管必须小心,因为气体喷射对于汽提CO2是必不可少的。剪切应力可能对亚分解水平的细胞代谢产生影响。对于 CHO 细胞,与 0.005 N/m2 (2 W/m3)的剪切应力相比,发现 0.8 N/m2 (60,000 W/m3)的剪切应力会显著降低细胞的特异性生产率。
对于相同的单位体积功率输入,混合引起的体积平均流体动力应力被证明与规模无关。相反,流体动力应力主要受生物反应器配置(挡板和叶轮的数量)的影响,尽管容器纵横比的微小差异和叶轮轴角的大变化不会产生显著影响。在大多数生物反应器中,平均能量耗散率通常在 10-80 W/m3 的范围内,而最大能量耗散率大约高出 100倍。悬浮的 CHO 细胞可支持高达 107W/m3的能量耗散率。当细胞暴露于远高于大型生物反应器的功率耗散率时,只有产品质量受到影响,这暗示在 CHO 细胞的情况下,由于混合导致的细胞损伤以前被高估了。Pluronic® F-68 是一种表面活性剂,可添加到培养基中以最大限度地减少细胞损伤和死亡。Pluronic® F-68 可降低表面张力并降低与液体界面处气泡破裂相关的特异性能量耗散。细胞在其膜中掺入了 Pluronic® F-68,从而提高了膜强度。此外,细胞内囊泡中高浓度的 Pluronic® F-68 可增强细胞的机械性能。但Pluronic® F-68 对减少细胞死亡的最大贡献可能是由于它降低了膜的疏水性,从而减少了附着在气泡上的细胞并经历了在破裂过程中产生的高度局部化的能量耗散。
本文为以下文献内容简介,详细内容,请参考原文。本文旨在知识、信息分享,转载请注明出处和原文。
原文:L.Lemire, P.L.Pham, Y.Durocher, et al., Practical Considerations for the Scale-Up of Chinese Hamster Ovary (CHO) Cell Cultures. Cell Culture Engineering and Technology, 2021.
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多