小分子TKI毒性来自何处?该如何防治?

小分子TKI的毒性限制其临床使用
小分子酪氨酸激酶抑制剂是一类重要的抗肿瘤药物,自2001年第一个TKI伊马替尼被FDA批准以来,到目前为止FDA已经批准了56个TKI。不少TKI药物在临床和商业化上取得了巨大成功,如用于淋巴瘤及白血病治疗的BTK抑制剂伊布替尼,疗效优异,2021年全年销售额达到了97亿美元;用于NSCLC治疗的EGFR三代抑制剂奥希替尼,可显著延长患者的PFS和OS,2021年全年销售额达50亿美元。
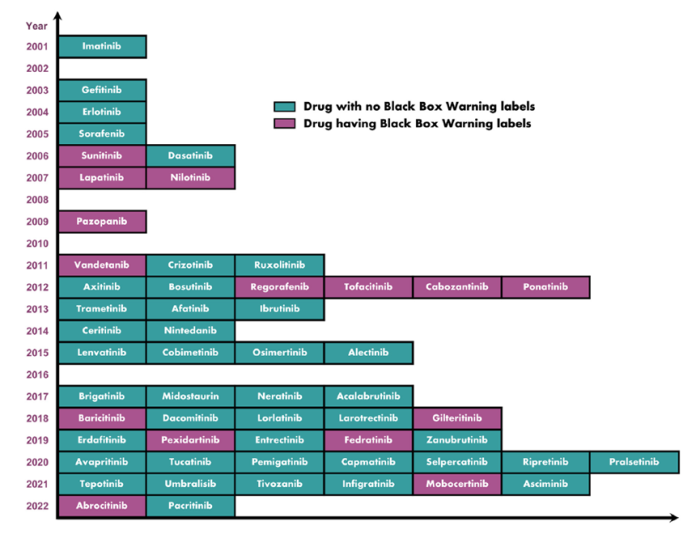
然而,TKI可能对包括心、肝、肺、肾、甲状腺、皮肤、胃肠道和神经系统等在内的器官和系统造成损害,极大的限制了他们的临床应用。批准的56个TKI中有15个带有黑框警告,意味着存在严重的毒副作用。如于今年2月获FDA批准的JAK抑制剂Abroctinib,便带有黑框警告标签,因其可能导致严重感染、死亡率、恶性肿瘤、主要不良心血管事件和血栓;2006年获批用于肾细胞癌的舒尼替尼则因为严重的肝毒性也被附上黑框警告。肝毒性是TKI最常见的毒副作用,通常表现为TKI诱导肝细胞坏死,此外,也可能出现胆汁淤积、肝纤维化、肝硬化、肝功能衰竭等毒副作用。
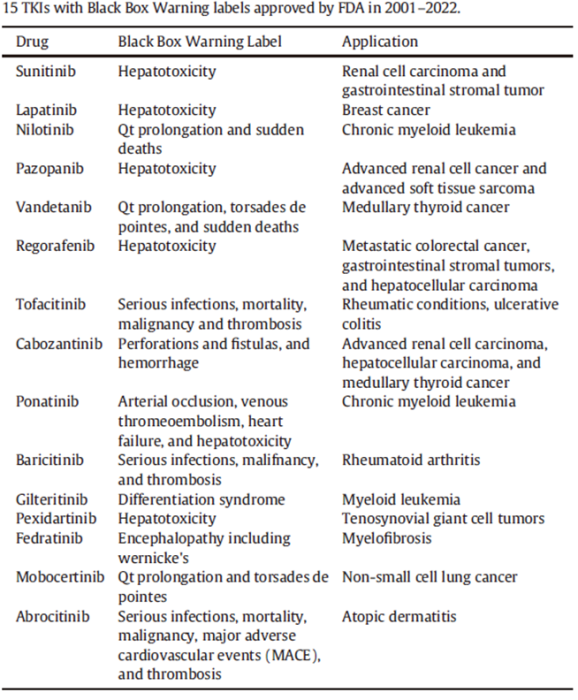
带有黑框警告的TKI

TKI的毒性来源于其活性代谢产物
TKI分子在体内代谢酶的作用下可能产生活性代谢产物/中间体,如亲电体以及活泼的自由基,能够与体内的生物大分子(如DNA、蛋白质、磷脂层)发生反应,改变他们的结构并影响其功能,还可通过共价或非共价结合对细胞器造成损害,从而导致毒副作用。批准的56种TKI中已有32种报导了体内活性代谢产物,代谢产物包括N-氧化物、醛、烯酮、醌亚胺、亚胺鎓、甲基醌、环氧化物、1,4-苯醌等,具有较强的反应活性,容易与体内物质反应造成损伤。
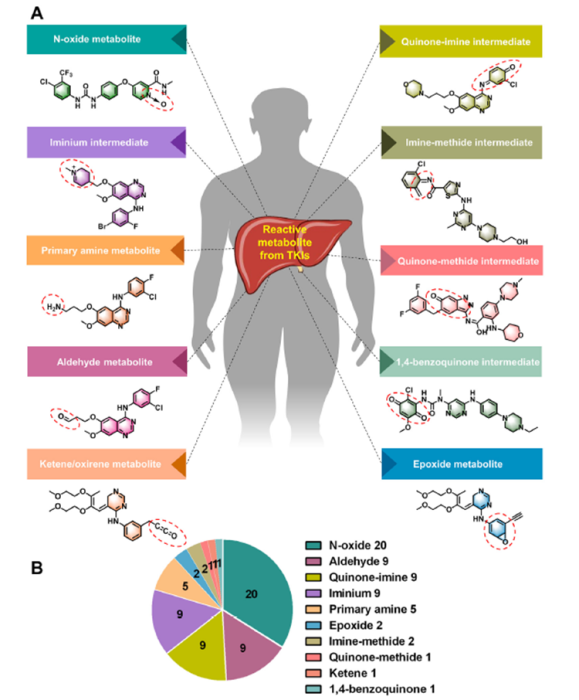
N-氧化物是TKI中最常见的反应代谢物,32种TKI中有20种报导了该类活性代谢产物,其次是醌亚胺、醛、亚胺活性代谢产物,32种TKI中有9种可观察到这些代谢产物。N-氧化物代谢产物具有细胞毒性,可产生活性氧并导致DNA损伤,此外也可抑制CYP3A4酶,导致药物-药物相互作用毒性。亚胺活性代谢中间体则可与宿主蛋白共价结合,产生免疫原性半抗原,还可对蛋白质和DNA发起亲电进攻,破坏其正常结构和功能,而在药物联用时,亚胺中间体还可与其他药物分子发生反应并导致毒副作用。
醛和烯酮同样是高反应活性的代谢产物,可与CYP3A4酶和血浆蛋白上的赖氨酸和精氨酸残基发生反应,抑制肝药酶的代谢活性以及血浆蛋白的结合能力;烯酮还能与血红蛋白的残基发生共价结合,破坏其结构并影响氧气运输能力。
醌亚胺则可作为迈克尔受体与蛋白或DNA的亲核基团结合,对细胞造成损害,也可作为反应性亲电体,与CYP3A4酶和血红蛋白部分的半胱氨酸和赖氨酸残基结合。此外,醌亚胺具有高氧化还原电位,能够进行氧化还原循环并形成活性氧,导致肝毒性、免疫毒性以及潜在的致癌作用。

TKI还可导致生物体内源性代谢紊乱
包括TKI在内的许多抗肿瘤药物对肿瘤细胞的代谢重编程是引发细胞抑制和杀细胞作用的重要机制,但如果药物脱靶,这也将导致毒副作用的发生。对索拉菲尼、厄洛替尼等TKI进行的代谢组学研究表明,这些TKI可以明显扰动糖代谢、氨基酸代谢、核苷酸和能量代谢、脂质代谢、肠道菌群、牛磺酸和亚牛磺酸代谢、酮体合成和降解、丁酸代谢、三羧酸循环、线粒体β-FAO、内质网ω -FAO、胆汁酸稳态、神经递质和硫胺素代谢等14条内源性代谢途径,使内源性代谢物增加或减少,从而导致副反应的发生。
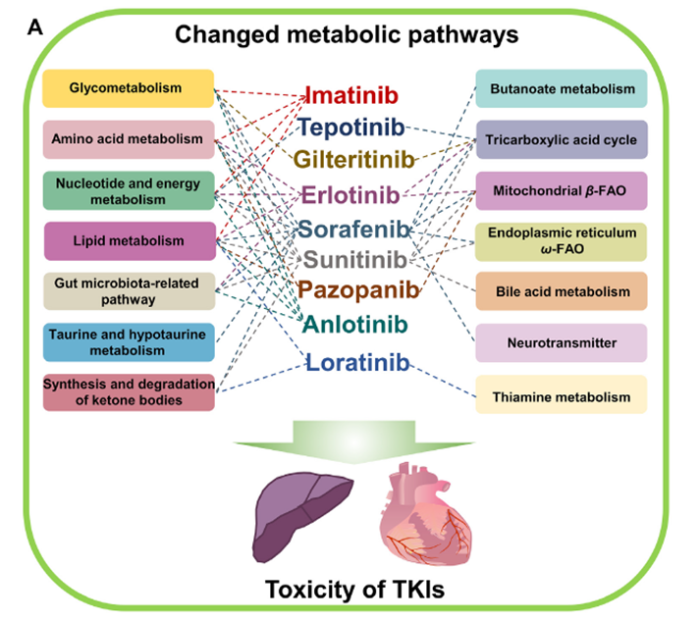
牛磺酸是肌肉组织中的代谢物,在维持肌肉收缩功能和Ca2+稳态方面发挥着关键作用。此外,牛磺酸还可以与生物膜相互作用,充当膜稳定剂,并调节磷脂代谢和膜组成。索拉非尼可引起内源性牛磺酸、亚牛磺酸浓度降低,因此,特别依赖Ca2+稳态来维持正常功能的器官和组织可能更容易出现索拉非尼诱导的毒性。索拉非尼影响牛磺酸水平的具体机制尚不清楚,但其对心脏中牛磺酸水平的扰动,已被证明和其诱导的心脏毒性有关,补充牛磺酸则可以削弱/消除其诱导的心脏不良反应。
左旋肉碱、乙酰左旋肉碱和丙酰左旋肉碱等短链肉碱对肝硬化、女性和男性生殖功能障碍、神经损伤、2型糖尿病和心脏病具有保护作用,长链肉碱则对体感传入、药物吸收和肝损伤有益,二者均是β-FAO代谢途径的内源性产物。厄洛替尼、索拉非尼、帕唑帕尼和舒尼替尼则可降低短链肉碱和长链肉碱的水平,从而导致肝脏和心脏毒副作用。索拉非尼和舒尼替尼还可以升高二羧酸(脂肪酸ω-氧化的产物)的水平,可能诱导单核细胞趋化和巨噬细胞分泌促炎细胞因子,被认为与肝损伤、皮肤癌、动脉粥样硬化的毒副作用有关。
三羧酸循环对于蛋白质、脂质和核苷酸等大分子的合成很重要,还对DNA甲基化、染色质修饰和翻译后修饰具有调控作用,三羧酸循环中的代谢物如柠檬酸、苹果酸、琥珀酸等可改善氧化应激和各种损伤。因此,抑制三羧酸循环将会导致睾丸和心脏毒性,舒尼替尼、特泊替尼等TKI的心脏毒性便由此而来。
另外,TKI还能降低有保护作用的脂代谢产物水平如ω -3 PUFA、增加会导致炎症的肠道微生物代谢物如胆汁酸的水平、增加会导致肝损伤和心血管疾病的亚精胺水平,从而导致肝、肾、肺、心脏、神经系统等器官和系统的损伤。

对症下药减轻TKI毒性
TKI引发心脏、肝、肾等器官、系统毒性的机制部分已阐明,因此可以对发生毒性的机制进行相应的调节,来保护器官免受/少受损害。
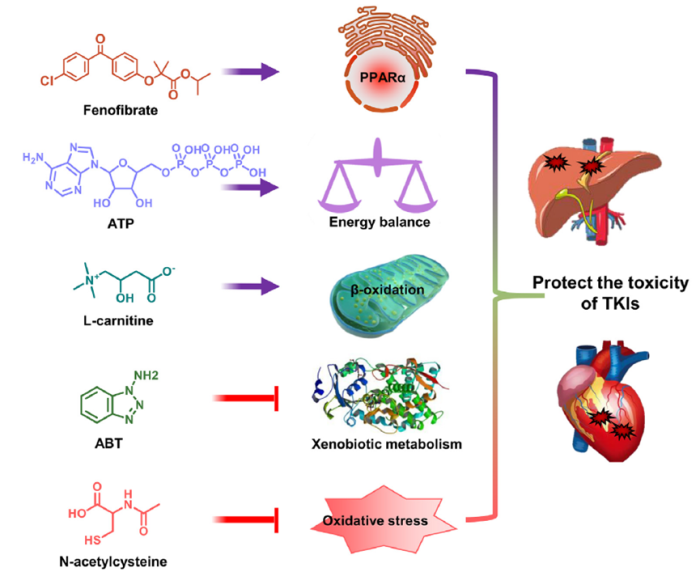
为了减少TKI有毒活性代谢产物的产生,可以使用肝药酶的抑制剂如1-氨基苯并三唑 (ABT)来抑制肝药酶活性,以此减少有毒代谢产物对人体的损伤。针对TKI诱导的肝损伤,则可以通过激动过氧化物酶体增殖物活化受体(PPARs),来调节线粒体β-FAO、胆汁酸代谢等过程的相关基因表达,以维持肝脏的脂质稳态、胆汁酸稳态,从而起到减少肝损伤的作用。
ATP除了可以为细胞提供能量,在应对组织损伤和细胞应激上也起到重要作用。根据报道,ATP 可以通过减少氧化应激来防止舒尼替尼引起的心脏毒性和皮肤损伤,还可以改善凡德他尼引起的皮肤损伤,另外,伊马替尼、索拉非尼、特泊替尼等TKI治疗后可观察到患者体内ATP、AMP水平的下降,补充ATP将有助于改善它们的毒副作用。
在应对氧化应激上,除了ATP,还可补充N-乙酰半胱氨酸,其作为抗氧化剂已被批准用于治疗扑热息痛中毒、心脏毒性、急性呼吸窘迫综合征、支气管炎、化疗毒副作用、重金属中毒等疾病,N-乙酰半胱氨酸已被证明可以减轻氧化应激并防止达沙替尼、帕唑替尼诱导的肝损伤及波纳替尼诱导的心血管毒性。补充N-乙酰半胱氨酸也可防止GSH被TKI代谢产物耗竭,N-乙酰半胱氨酸有望成为减轻 TKI 毒性的通用药剂。
总结
小分子TKI的毒性一方面来源于其活性代谢产物(如氧化物、自由基)与人体生物大分子发生反应导致的损伤,另一方面则来自于对人体内源性代谢途径的干扰,导致内源性代谢物的减少或增加,从而引发或加剧相应的器官损伤。针对引发毒性的机制进行精准干预则可以减轻使用TKI带来的毒副作用,目前临床前研究已经证实了PPARα 激动剂、CYP 抑制剂ABT、N-乙酰半胱氨酸和左旋肉碱补充剂对几种TKI诱导毒性的改善作用,但我们仍需要做出更多努力,寻找更多有潜力的解毒靶点,来提高TKI临床使用安全性,拓宽TKI临床应用场景,造福更多患者。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多