CAR-T细胞疗法开发的新突破-非病毒载体的应用

介绍
1. CAR-T免疫治疗在恶性血液病中的兴起
CAR-T细胞疗法打破了原有T细胞对肿瘤治疗的束缚。CAR介导的T细胞直接与肿瘤相关抗原识别,引起强大细胞毒性反应、相关细胞因子分泌和T细胞增殖。到目前为止,在临床应用CAR-T技术主要靶向CD19和CD22两个靶点,并可以有效治疗B细胞-急性淋巴细胞白血病(B-ALL)和B细胞淋巴瘤,在B-ALL中,早期采用CAR-T细胞过继免疫疗法可达80%治愈率,并可建立免疫记忆实现持续应答。截至2022年初,FDA已经批准了五种CAR-T细胞疗法,分别为Abecma、Breyanzi、Kymriah、Tecartus、Yescarta,并已经在多个国家和地区使用。
2.一个更加灵活的系统是必要的对于未来的CAR-T疗法
T细胞可以被修饰以表达不同特异性的CAR,到目前为止,大多数临床试验中批准或研究的CAR-T细胞疗法都是利用病毒载体方法对T细胞进行改造,特别是伽玛逆转录病毒和慢病毒载体,病毒载体具有高效的基因转移能力和长期的应用历史,在过继T细胞治疗方面证明是安全的。然而,病毒载体转导长链基因的能力受到衣壳尺寸的限制,病毒衣壳的直径约为100纳米,通常不能容纳超过8-9kb;并且病毒的生产条件比较严格,需在生物安全二级(BSL2)设施的良好制造规范(GMP)条件下进行,需要较高的生产成本。因此,为了更好的应用CAR-T细胞疗法,降低治疗费用,非病毒载体改造方法应运而生,非病毒基因转移使得生产过程更容易,商品成本更低,并能快速应用。
3.病毒载体KO非病毒载体
病毒载体系统相对完善,也是目前广泛应用的方法,但其主要存在以下几点不足1.对插入基因片段大小有限制;2.难以产生高滴度的稳定的媒介粒子;3.生产过程中可能产生复制能力强的逆转录病毒/慢病毒,产生针对载体编码表位的体液和细胞免疫反应。而非病毒载体主要以转座子为代表,可以实现稳定的基因转移。转座子最初是由诺贝尔奖获得者遗传学家芭芭拉·麦克林托克在20世纪40年代研究玉米籽粒颜色变异时发现的,这种可移动的转座子结构在基因组中相当丰富。此外,其可搭载更大的货物体积,可以实现多目标的需求。并且转座子系统在预激活和休眠的原代T细胞中都能很好的工作,并且非病毒转座子载体还具有低免疫原性和易于生产等优点。

非病毒载体系统
1.SLEEPING BEAUTY
“睡美人”(SB)是从鱼类基因组中非活性转座子序列重构而来,是第一个在脊椎动物细胞中显示活性的转座子,为基因治疗开辟了新领域。这些有活性的转座子能够通过剪切粘贴机制从一个基因组位置转移到另一个位置。SB载体由两个功能成分组成,一是转座子DNA:携带两端被ITR包裹的基因,二是SB转座子酶:识别ITR序列并将基因从供体DNA转移到基因组内的受体位点。
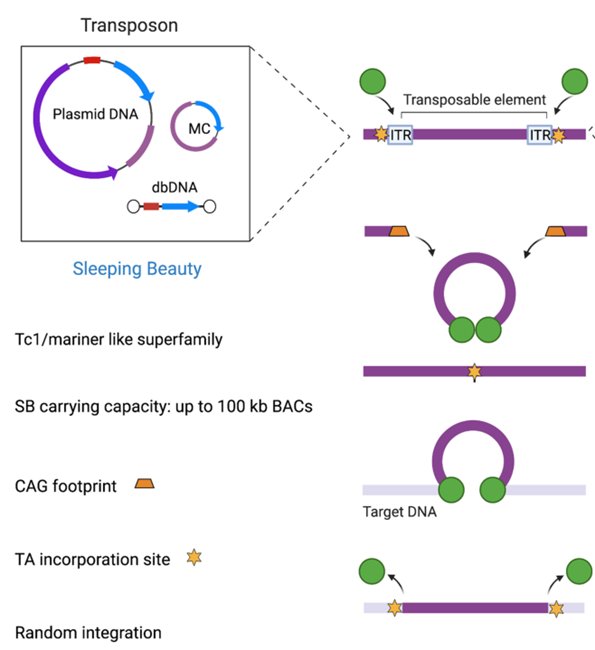
当转座酶识别到SB供体转座子两侧的ITR序列并与之结合后,诱导形成环状突触复合体,产生的切除部位通过宿主非同源末端连接(NHEJ)和SB转座子末端序列迅速修复,切割之后在供体DNA上产生一个特定的标记,此时,转座子-转座酶复合体可以自由地在基因组中找到合适的靶点并在内部整合。SB载体系统与其他的载体系统如PB、 MLV衍生的γ逆转录病毒和HIV衍生的慢病毒载体系统相比,SB载体具有最高的安全性,并具有更大的外源基因容量。目前在在临床前和临床实验中都具有很好的安全性和疗效。
2.PIGGYBAC
PB最初从白菜蛾Trichoplusia ni中分离得到,与SB载体一样,PB系统由PB转座酶(DNA或mRNA形式)和携带目的基因质粒组成。为了提高转座酶的转座效率,通过随机突变的方法对转座酶进行了优化,产生有用的变体,如常见的hyPBase。
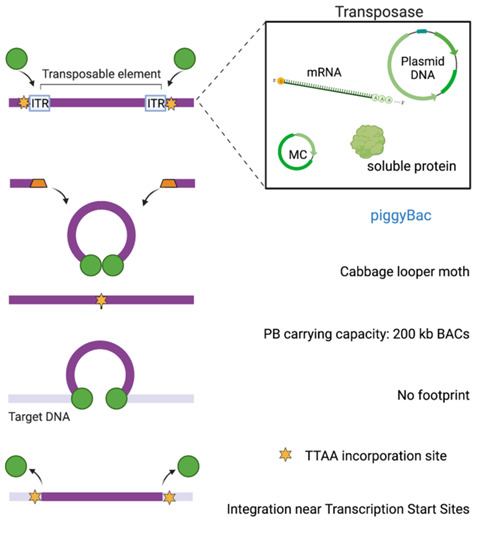
图2:PIGGYBAC转座子系统
PB转座子载体的设计特点是在PB中有一个单独的开放阅读框(ORF),两侧是典型的不对称ITR。转座酶识别转座子两侧的ITRs,并通过剪切粘贴机制催化载体基因切除并整合到基因组DNA中。PB的一个特殊之处在于它对TTAA位点的特异性,而不是SB对TA二核苷酸的特异性。PB转座酶的另一个优点是其发挥作用后在供体DNA上没有足迹,研究表明只要细胞中持续存在活跃的转座酶,整合的转座子就可以被重新激活到新的位置。如果转座子已经整合到基因组中,在切除部位产生的足迹可能会产生他们所在基因的不良突变,基于此,PB载体系统具有很好的安全性。与病毒载体相比有更大的载货容量(可达14kb)。目前越来越多的临床前实验证实了PB系统的CAR T制造平台的可行性和安全性,使该系统进入临床试验,澳大利亚的一项I期研究表明,通过PB转座子系统获得的供者来源的抗CD19 CAR T细胞在CD19+B细胞恶性肿瘤患者中具有很好的疗效和安全性。
3.mRNA
RNA已在多领域广泛应用, 但其稳定性和翻译效率一直是RNA发挥功能的决定因素。这些特征由顺式作用元件决定,包括5‘帽结构、polyA尾巴、编码序列以及非翻译区(UTRs),RNA中的这些顺式作用元件与反式作用的细胞因子共同作用,完成翻译和蛋白质生产过程。
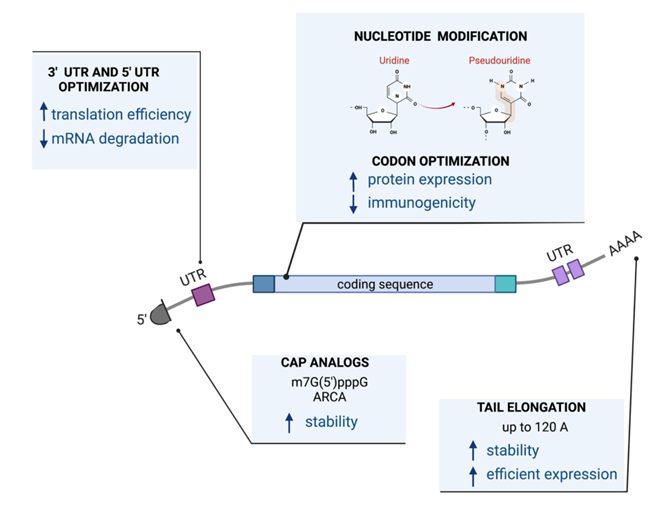
图3:mRNA载体
为了提高mRNA的表达效率,可以进行以下优化:1.密码子优化,改变同义密码子以增强mRNA在靶组织或细胞中的表达或减少降低翻译水平的RNA的二级结构。2. 生产带有修饰的核糖核苷的RNA分子,如假尿苷,已经显示出通过减少对Toll like受体(TLRs)的刺激而提高翻译能力并降低免疫原性。3.对5’帽结构和3’polyA尾巴进行修饰,提高稳定性和翻译效率。4.对非编码区域修饰增强翻译效率。在许多体内和体外的临床实验中,已使用mRNA将CAR导入T细胞,用于在血液肿瘤、慢性淋巴细胞白血病(CLL)、急性髓细胞白血病(AML)、ALL和实体瘤治疗,在肿瘤模型中都表现出肿瘤生长抑制和细胞毒性。
4.病毒-转座子混合载体
病毒-转座子混合载体结合了病毒载体的感染特性和转座子的整合特性。常用的病毒载体为重组腺病毒载体,其具有载量大和高效转导等优点被广泛应用,并在病毒基因组中加入整合元件可以增强其整合效率。研究显示将AAV载体与PB转座子系统相结合,可以治疗1型糖尿病、囊性纤维化等疾病。
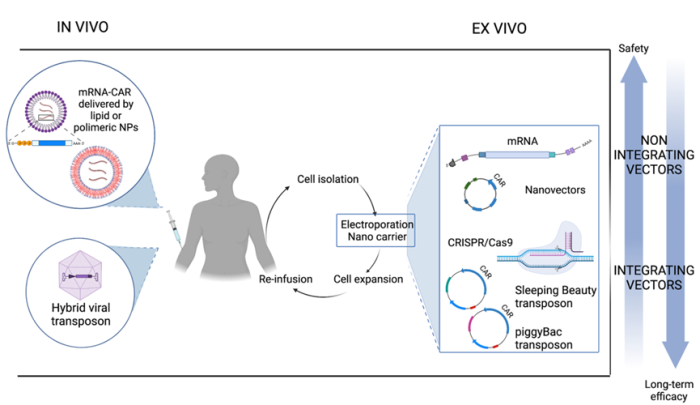
图4:非病毒载体CAR-T细胞产生过程

非病毒CAR-T细胞疗法的未来
为了应对未来的挑战,纳米载体的应用可能是克服目前基因传递中的障碍(如毒性和低转染效率)的解决方案,目前Bozza等开发了一种非整合DNA纳米载体,能够产生在体外和体内都很活跃的CAR-T细胞。此外随着CRISPR/Cas9系统的发展,定点插入方法也正在快速的发展,推动了非病毒载体的发展。用转座子载体设计的非病毒CAR-T细胞已经在早期临床试验中显示出一些较好效果,但这种系统是否也会出现意想不到的毒性和相关的临床结果仍需在其他临床研究中观察。期待在未来的临床试验中看到这些技术广泛的应用。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多