载药微球是指药物溶解或分散在高分子基质材料中形成的球状微粒。微球制剂可以缓慢释药,从而减少给药次数,降低血药浓度的波动,发挥长期治疗效果。将磁性物质引入微球中或对载体材料进行修饰[1],可使微球磁性靶向或主动靶向到病灶处,提高靶部位的有效血药浓度,降低药物的全身毒副作用。将微球导入肿瘤动脉中,可通过栓塞治疗方式杀死肿瘤细胞,在阻断肿瘤的营养、血液供给的同时释放药物,进一步增加治疗效果。此外,微球制剂还可掩盖药物的不良气味,降低刺激性,提高药物的稳定性。
本文在调研大量文献的基础上,从微球制剂结构分类、制备方法和应用角度分别进行阐述,以期为后续研究提供借鉴和参考。
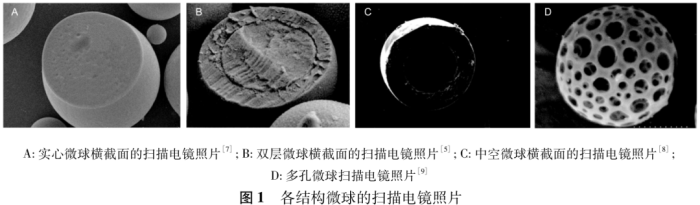
就国内外研究现状,根据微球制剂微观结构的不同可将其分为实心微球、双层微球、中空微球和多孔微球。
微球制剂被广泛运用于长效缓释注射剂的开发。1985 年第一个微球制剂 Enantone(亮丙瑞林长效缓释注射剂)成功上市,主要用于前列腺癌和乳腺癌的治疗。通过合适方法将药物装载于聚合物材料中,可得到低孔隙率、表面光滑的实心微球。将实心微球通过肌内或皮下注射的方式注入体内,载体材料在体内微环境中缓慢降解,从而引起药物的释放,选择合适降解速率的载体材料可以实现长达数月的药物释放周期。如何将其他需长期服用的药物也成功载入实心微球中,并实现良好的长期治疗效果,一度成为缓释制剂领域的研究热点。随着研究的展开,诸多结果显示,普通实心微球在包载药物时,特别是水溶性药物,会在释放初期短时间内大量释药[2-3],出现突释现象。较高的突释量可能导致血药浓度超过毒性阈值水平,产生毒副作用。
为了改善实心微球的释药弊端,有研究者[2,4]提出在原有载药微球外包裹上一层聚合物外壳,引入无药外壳作为释放屏障可以降低药物的突释量。这种具有核壳结构,核心由一种聚合物材料构成,另一种聚合物材料包裹内核形成外壳的微球,被称为双层微球 。药物的释放速率可以通过壳层的厚度进行调控,附加的外壳结构也有利于提高药物的包封率[5]。
类比双层微球,只保留球形外壳,球核心处为一空腔的微球,为中空微球,或空心微球。中空微球的空腔结构非常适合药物的装载,因此常用作各种疏水性药物、蛋白质、基因(核酸) 等小分子物质的递送载体[6]; 此外,低密度特性和良好的漂浮性能使得中空微球也常用于胃漂浮给药系统的研究。
普通实心微球制备过程中,有机溶剂的挥发会在微球的内部或外表面形成微小孔道。而在实心微球的处方基础上加入致孔剂,可以在微球内外形成大量孔径大且相互连通的孔隙,得到具有高比表面积、低密度、高孔隙率的多孔微球 。通过调节致孔剂的种类和用量可以制备得到具备良好空气动力学粒径的微球,因此多孔微球常用于非注射途径的肺部吸入制剂的研究。这些独特结构的开发使得微球制剂的应用范围进一步扩大。
载药微球的制备方法繁多,常见的制备方法有溶剂挥发法、喷雾干燥法、相分离法、微流体技术、静电喷射法等。这些方法在不同结构微球的制备中可能都有使用。但即便是同一方法,用于制备不同结构的微球时,其制备参数、结构形成原理也会有所差别,如溶剂挥发法。以下列举了在各结构微球的制备中常用的方法。
溶剂挥发法是制备微球常用的方法,其操作简单、工艺参数控制方便[10]。其制备过程可以简单概括为将药物溶解、分散在纯化水或有机溶剂中,再与聚合物溶液混合或乳化,最后注入外水相中,随着有机溶剂的扩散挥发得到固化微球。
Zhao等[11]采用溶剂挥发法制备了异哌酮的微球,使用的载体材料为聚乳酸羟基乙酸共聚物(PLGA)。通过对聚合物浓度、均质化速度和理论载药量等参数进行优化,制备得到了表面光滑的载药微球,其平均粒径为82μm,包封率高达92%。
相分离法是将药物溶解、分散或以乳滴形式混合于溶有聚合物的有机溶剂中,然后向有机溶剂中加入相分离试剂,使得聚合物材料溶解度降低而析出,包裹药物、形成凝聚相小液滴。最后引入萃取剂,除去有机溶剂和相分离试剂,固化微球[12]。
Chen等[13]采用相分离法制备了酸醋曲普瑞林微球。通过超声将药物粉末分散于PLGA溶液中,随之向其中加入硅油作为非溶剂进行相分离,最后将上述溶液转移至正庚烷中固化微球。通过对各项处方因素的优化,可制备得到包封率为71.35%、突释量低至0.78%的载药微球。
喷雾干燥法制备微球快速、操作简单,比较适合微球的大批量生产。通常将含有药物和聚合材料的溶液、乳液或混悬液通过喷头,以雾化状态喷入热空气流中,干燥固化得微球粉末[14 -15]。
Shi等[16]采用喷雾干燥法制备了亮丙瑞PLGA微球。采用该法制备得到的微球表面一般略显粗糙或带有褶皱,聚合物浓度不高时,微球为球形; 聚合物浓度过高时,可能会出现不规则的颗粒物。体外释放结果显示,该载药微球可持续缓慢释药63d。
制备过程和“2.1.1”项下基本一致。但制备双层微球需要使用2种聚合物,根据2种聚合物材料在不同溶剂中的溶解度不同,在两聚合物溶液中引入核层聚合物的不良溶剂,使得核层聚合物先固化,随后壳层材料固化包裹核心形成双层微球。
Naraharisetti等[17]采用改良的溶剂挥发法制备了庆大霉素双层微球。选用的壳层材料为PLGA,在二氯甲烷和乙酸乙酯中皆可溶解; 核层材料为聚左旋乳酸(PLLA),可溶于二氯甲烷,但不溶于乙酸乙酯。制备时将药物和PLLA分散或溶解于二氯甲烷中,将PLGA溶解于乙酸乙酯中。将两聚合物溶液超声混合,PLLA不溶于乙酸乙酯,会自发形成半固态小液滴,PLGA在其周围分布。最后将混合溶液转移到外水相中,随着溶剂的扩散挥发,核层处PLLA先析出,外层PLGA随后固化。制备得到的双层微球粒径在100~600μm之间且可持续缓慢释药15d。
微流体技术是一种操控微体积液体的新技术[18]其基本原理是互不相溶的两相溶液在微通道中交汇,在外力或流动的剪切力的作用下被分割成微米级乳液液滴,最后挥去溶剂固化得到微球。
Berkland等[5]采用改进的微流体技术,制备了聚乙丙交酯(PLG)、聚(1,6-双羧基苯氧基) 己烷( PCPH)的双层微球。将PLG和PCPH分别溶解于二氯甲烷中,得到内核和外壳溶液。将内核溶液置于双同轴喷嘴状管路的内部通道,将外壳溶液置于外部通道。调节两聚合物溶液的流速,用可控声波将双聚合物流体分割成液滴进入外水相中。制备得到的双层微球粒径约为50μm,具有明显的核壳结构且内核处于球体的中心位置.控制2种聚合物溶液的流速,可调节微球的壳层厚度从2μm到数十μm。
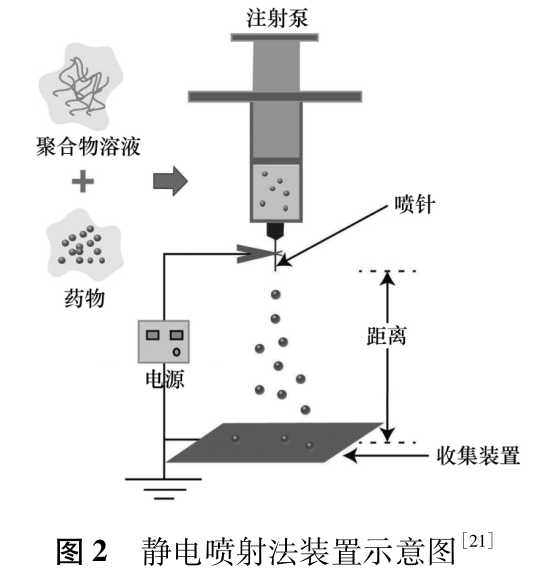
静电喷射又称电流体动力雾化,其制备装置主要由外加电场、注射泵、收集装置三部分构成[19]。高分子溶液在外加电场的作用下获得静电作用力。当静电作用力大于液滴的表面张力时,溶液在喷头针尖喷射而出[20]。带同种电荷的小液滴在库仑斥力作用下分散,进入收集装置,最后干燥、固化,得到微球。
Zhou等[2]采用单针静电喷射的方式制备了以PVA为内核、聚己内酯(PCL)为外壳的双层微球,用于阿霉素的包载。首先,采用纳米沉淀法制备得到含药PVA纳米粒。然后将PCL和PVA纳米粒溶解或分散到二氯甲烷中,将此混合溶液转移到注射器中,调节外加电压的大小、注射针头到收集装置的距离、注射器流速,静电喷射、收集、固化,得到PVA/PCL双层微球。单纯PVA纳米粒体外释放时,前5h的释放量高达69.8%,而包裹上PCL外壳的双层微球的突释量降至33.8%。
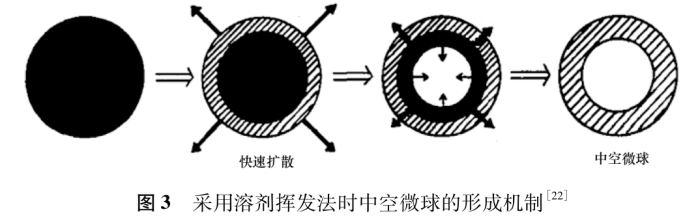
溶剂挥发法是制备中空微球的常用方法,操作过程同“2.1.1”。一般会使用 2种溶剂混合溶解载体材料,常用的为乙醇/二氯甲烷的混合液,间或混合异丙醇、丙酮、乙醚等。微球固化干燥阶段,在连续相中溶解度较高或挥发性更好的溶剂会较快扩散除去,使得乳滴外部聚合物析出、固化、沉积形成薄膜; 而另一种溶剂缓慢扩散挥发,内部聚合物随之固化,由内向外收缩,于中心处形成空腔,见图3。
Zhu等[8]以乙醚和乙醇为溶剂,乙基纤维素和卡波姆934P为载体材料,通过溶剂挥发法制备了双嘧达莫中空微球。将药物、乙基纤维素和卡波姆934P溶解在乙醇和乙醚混合溶液中,然后转移到外相液体石蜡中搅拌,形成稳定乳液。乙醚快速扩散挥发,乙醇缓慢挥发除去。制备所得中空微球具有良好的漂浮性,73%以上的微球在胃液中可漂浮近12h。
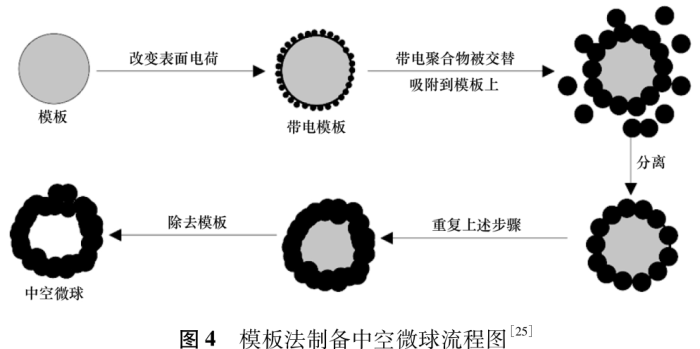
模板法的特点是壳层材料在氢键、静电作用等方式的驱动下被吸附、固化到模板材料上,最后通过溶剂溶解、高温煅烧、清洗等方法除去模板,得到中空微球,见图4。可以做模板的材料有聚合物微球、表面活性剂、胶束、囊泡等[23 -24]。
Li等[26]以聚2-丙烯酰胺-2-甲基丙烷磺酸(PAMPS)为模板,制备得到聚苯胺中空微球。将PAMPS溶于乙醇/水混合溶剂,得到稳定胶束溶液,再向其中加入苯胺。PAMPS分子侧链中存在大量磺酸基,可以将苯胺吸附、穿插到PAMPS胶束上,最后加入过硫酸铵,在过硫酸铵的氧化作用下,苯胺聚合形成聚苯胺。经丙酮处理后,离心、干燥得到聚苯胺中空微球。调节PAMPS/苯胺摩尔比从1/40到1/10时,微球的外观由原来的不规则状逐渐变得均匀且圆整。制备得到的聚苯胺中空微球平均粒径约为410nm,壳层的厚度约为72nm。
溶剂挥发法制备多孔微球的操作过程与“2.1.1”项下基本一致,不同之处在于多孔微球的制备需要加入致孔剂,通过调节致孔剂的种类和浓度,可以得到合适孔隙率的多孔微球。致孔剂的种类多样,主要有气体生成型致孔剂(如碳酸氢铵、碳酸氢钠、过氧化氢) 、渗透型致孔剂(氯化钠、氯化钾等) 和可提取型致孔剂(Pluronic,脂肪酸盐等) 。
Wang等[27]在制备牛血清白蛋白PLGA多孔微球时,内水相中加入碳酸氢铵作为致孔剂。碳酸氢铵在制备过程中分解释放气体,从微球释出,形成孔道。
Lee等[28]在制备血管内皮生长因子的多孔微球时,选用牛血清白蛋白(BSA)为致孔剂。BSA作为渗透性致孔剂,加入内水相中,使得内水相的渗透压高于外水相。内外水相之间的渗透压差驱使外水相的水分子渗入内水相中,导致微球形成内外相互连接的多孔结构。
Kim等[9]在制备棕榈酰化醋酸艾塞那肽微球时,致孔剂为Pluronic。将PLGA和Pluronic F68加入二氯甲烷中超声溶解,然后转移到外水相乳化、挥去有机溶剂。当外水相与二氯甲烷之间发生溶剂交换时,共溶于二氯甲烷的混合物被分为PLGA富相和PluronicF68富相。在溶剂挥发过程中,PluronicF68从有机相被萃取分离到外水相中,形成多孔微球[29]。
悬浮聚合法也是制备多孔微球常用的方法。在混悬剂的存在下,将聚合单体、引发剂、致孔剂悬浮于液相基质中,进行聚合反应,反应完全后将致孔剂除去,即可得多孔微球。反应中常用的致孔剂为有机溶剂和线性聚合物。
Cai等[30]采用悬浮聚合法制备了含环氧基的多孔微球。向圆底烧瓶中加入环氧丙基炔丙醚、1,7-辛二炔、1,3-二巯基丙烷、安息香二乙醚(DMPA) 、聚乙二醇(PEG)和氯仿,其中DMPA为光引发剂,PEG为聚合物型致孔剂。搅拌均匀后,加入十二烷基苯磺酸钠溶液,将烧瓶浸入冰水浴中、紫外线照射下搅拌反应。环氧丙基炔丙醚、1,7-辛二炔、1,3-二巯基丙烷在低温条件下进行光引发的聚合反应。致孔剂PEG在反应生成的聚硫醚中不可溶,发生相分离。反应完成后水洗可除去PEG,得到多孔微球。相比于小分子溶剂型致孔剂( 甲苯、正庚烷等) ,聚合物型致孔剂PEG的分子量和黏度较高,有利于相分离和大孔隙的形成。调节PEG的用量,可得到孔隙率为62.45%、孔径5~10μm、且孔洞连续的多孔微球。
3.1 实心微球的应用
现已有10余个注射用缓释微球产品成功投入市场[31],包载的药物主要为多肽类和精神类药物。多肽类药物一般半衰期较短,口服生物利用度极低,因而多采用注射给药; 若对应病症需要长期给药治疗,频繁注射会给患者造成极大痛苦和不便。精神病治疗周期较长,患者拒服或漏服药物都可能加重病情。将上述药物制成长效微球制剂可显著提高患者的用药顺应性。
Pervaiz等[32]制备了非典型抗精神病药物奥氮平的PLGA微球制剂。将微球悬浮于生理盐水通过皮下注射进入大鼠体内,以考察载药微球的体内释药行为。结果显示,合理调控共聚物中乳酸和羟基乙酸的比例和分子量,可以得到低突释、平稳释药1个月的缓释微球制剂。
微球的动脉栓塞治疗,即在X 光照射下,将载药微球通过导管注入肿瘤动脉中,阻断肿瘤处血液、氧气和营养物质的供应[33]; 同时在病灶部位缓慢释放抗癌药物,实现治疗肿瘤的目的。目前,已成功上市的栓塞微球产品有英国Bio-compatibles公司的DCBead、美国BioSphere公司的Hepasphere和国内恒瑞公司的CalliSpheres和8Spheres。其中CalliSpheres是国内首创且拥有独立知识产权的栓塞微球产品,通过物理作用吸附装载化疗药物,具有载药量大、可载药种类多等优势。
Chen等[34]制备了改性丝蛋白动脉栓塞微球。采用兔耳模型对微球的栓塞效果进行了评价,将微球注入兔耳中央动脉后的第3周,兔耳动脉萎缩消失,远心端周围组织坏死,表明该微球具备良好的栓塞作用。
传统的单层微球装载药物时,特别是亲水性药物,会存在突释过高、包封率不高的情况。而双层微球中,药物被包裹在内核聚合物中,无药外层作为释放屏障,可以显著降低药物的突释量。
Devrim等[35]制备了包载亲水性药物卵清蛋白的双层微球。采用的2种聚合物材料是PLGA (50/50)和其他型号PLGA或聚乳酸的组合。实验结果表明,相比单一聚合物PLGA(50/50)制备得的实心微球,双层微球显著降低了药物的突释量,提高了包封率。单层微球包封率为64.11%,突释量为 44.11%;PLGA(50/50)、聚乳酸双层微球突释量仅为10.36%,包封率可达93.98%。
许多疾病的治疗需要多种药物联合使用,如肿瘤的化疗[36]、帕金森病后期患者的治疗还有高血压[37]等疾病的治疗。双层微球可将2种药物分别载入内核和外壳中,发挥协同治疗作用[38]。
Xu等[39]制备了聚乳酸壳层包裹 PLGA 内核形成的双层微球。将阿霉素载入双层微球的内核,壳聚糖-DNA 纳米粒(chi-p53) 载入外壳中。阿霉素通过抑制核酸复制导致癌细胞凋亡; 壳聚糖-DNA纳米粒内含编码p53肿瘤抑制蛋白的基因,可使癌细胞对抗癌药物敏感。该研究中,双层微球同时释放阿霉素和chi-p53,与分别装载Dox 和chi-p53的微球或相应的游离药物相比,对肝癌HepG2细胞的增殖具有更高的抑制作用。
胃漂浮给药系统是一种相对密度低于胃内容物而漂浮于胃液之上的制剂,能延长药物在胃部滞留时间,提高生物利用度[40]。中空微球具有低密度特性和良好的漂浮性能,是一种新型、备受关注的多单元胃漂浮给药系统。相比一单元给药的漂浮片剂,漂浮微球能显著减小个体差异,避免药物剂量“全或无”的不良现象,弱化消化道食物节律带来的影响[41]。
Wei等[42]制备了乙基纤维素的中空漂浮微球,用于包载抗溃疡药物盐酸雷尼替丁。体外实验结果显示,该制剂在人工胃液中的漂浮时间和持续释药时间长达24h。体内药动学实验数据表明,相比市售胶囊剂,该中空微球减少了血药浓度的波动,且生物利用度约为胶囊剂的3倍。
中空微球主要由球形外壳和内部空腔构成,没有致密的内核。若选用功能性材料制备中空微球的外壳,可以使中空微球对外部环境刺激(如pH、磁场、温度等) 产生相应变化[43],从而实现药物的响应性释放。
Li等[44]选用聚乙二醇壳聚糖接枝共聚物(CS-g-PEG)为阳离子材料,柠檬酸盐修饰的四氧化三铁纳米粒(Fe₃O₄-CA)为阴离子材料,制备了具有 pH 响应性磁性复合中空微球。将抗肿瘤药物阿霉素通过孵育的方式载入响应性中空微球。该微球的体外释放结果显示,在低pH的释放介质中,微球释药速度较快,此时CS-g-PEG中的氨基被质子化,导致微球壳层膨胀,通透性增加,有助于实现药物在酸性肿瘤微环境中的释放。此外,由于Fe₃O₄ -CA的掺入,中空微球的磁化强度为64.14%,饱和磁化强度为37.23emu·g-1,显示出良好的磁靶向潜能。
肺部给药具有无首过效应、吸收迅速等优势。载药粒子要实现有效的肺部沉积,要满足空气动力学粒径在1~ 5μm(小于0. 5μm时,载药粒子会被气流呼出) 、几何粒径大于10μm(小于5μm时会被巨噬细胞吞噬清除)[45-46]。普通实心微球空气动力学粒径和几何粒径近乎相等,并不能满足肺部给药的要求。而多孔微球可以通过调节粒径和孔隙率成功在肺部沉积,同时实现药物的控制释放,这使得多孔微球成为近年来最受关注的肺部给药的载体之一[47]。
Feng等[48]制备了包载阿霉素和紫杉醇的多孔PLGA微球,通过吸入途径进入肺部,以治疗肺癌。制备得到微球的几何平均粒径为(11.47±2.71)μm,空气动力学粒径为(3.52±0.83)μm,有利于形成气溶胶,沉积于肺部。动物实验结果表明,该载药多孔微球抑制了B16F10细胞致瘤小鼠的肺部癌细胞的扩散增殖,具有良好的肺部抗肿瘤效果。
由于多孔微球具有比表面积大、吸附性能好等独特优势,用于经皮给药系统时,能有效吸收皮肤表面的分泌物,为创面提供有效保护。多孔微球粒子是微小、惰性球体,不会透过皮肤进入体循环,具有良好的安全性。将药物载入多孔微球可实现药物的缓慢释放,在不降低药物疗效的前提下显著减少药物对创面的刺激性。且多孔微球在使用体验上优于软膏,不会带来油腻、黏稠的不适感,同时清洗方便[49]。
Zhang等[50]制备了包载积雪草苷的多孔微球。积雪草苷可促进创面处成纤维细胞增殖、胶原蛋白合成以及血管再生。体外释放实验显示,该积雪草苷多孔微球可稳定持续释药25h。在大鼠背部创伤部位每2d涂抹一次积雪草苷多孔微球,每4d记录一次创面面积以考察该制剂对创面愈合的作用。相比游离药物组和空白对照组,载药多孔微球组促进伤口愈合的作用趋势更明显,并于d7和d14表现出显著性差异。
近年来,多孔微球被广泛应用于组织工程研究中,以帮助细胞生长和修复缺陷组织。多孔微球具有高孔隙率、比表面积大的结构特性,有利于细胞的黏附、迁移和增殖[51,52]。微球之间的孔隙和微球表面的小孔隙都为血管和细胞的生长提供了空间,同时也可将细胞生长因子等药物载入多孔微球中,促进组织再生过程中的细胞增殖。
Seong等[53]制备了磷酸钙、胶原蛋白复合多孔微球,以包载促进骨再生的生长因子,其中载体材料磷酸钙陶瓷具备良好的生物可降解性。将该多孔微球植入髌骨外侧脱位的雄兔体内4周后,在原骨骼缺陷处生长出了新生骨组织。结果表明,装载生长因子的多孔微球能有效地促进组织再生。
药物从实心微球中的释放主要由扩散和聚合物降解机制主导,通常呈现出三相释放模式: 突释期、释放停滞阶段、释放后期。骨架材料降解缓慢,药物无法从微球中扩散释放时,药物的释放会出现较长的停滞期。在释药停滞期,为维持有效血药浓度需要辅助口服给药[54],从而显著降低了患者的用药顺应性,不利于临床治疗。多孔微球具有较高的孔隙率、比表面积,有利于药物的扩散和体液的浸入,在缩短停滞期方面具有较高的潜在价值。
Kim等[55]分别制备了包载孕酮的多孔、实心PLGA微球,对2种不同结构微球的关键质量属性进行了考察。药物释放曲线显示,多孔微球释药速度快于实心微球,且无明显的停滞期,可持续释放孕酮长达16d,能实现药物的持续不间断释放。
微球制剂问世至今,受到了医药领域的广泛关注,现已有数十个微球产品成功上市,主要包括长效缓释微球和栓塞微球,皆为实心微球。目前对于其他结构微球的研究还处在发展阶段,并未有产品获准进入临床使用。此外,关于各结构微球的研究尚存在许多不足之处,有待进一步优化。例如,实心微球用于长效缓释注射剂时,存在着高突释、中期释药停滞等问题; 双层微球结构重现性差,质量控制困难; 中空微球包载药物时普遍存在包封效率低等问题; 多孔微球制备过程中加入的致孔剂并不能完全除去,且用作肺部吸入给药时存在潜在刺激性。
对于已经上市的微球产品而言,建立具备良好体内外相关性的释放方法、完善现有质量评价标准仍是今后研究中亟待解决的问题。对于还处在研发阶段的微球制剂,如何提高包封效率、优化体外释药行为、发挥体内治疗作用以及实现产业化,都是当下的研究热点和难点。相信随着研究工作的深入,关于各结构微球的制备方法、质量评价、应用研究会逐步得到完善。













评论
加载更多