生物制品病毒安全检测的原则和趋势
引言
病毒污染是威胁治疗用生物制品用药安全的重要风险,病毒污染恶性事件在历史上多次发生,20世纪八九十年代,曾出现患者由于使用污染了病毒的血液或血液制品而感染丙肝病毒(HCV)或艾滋病病毒(HIV),或感染HIV的恶性事件,造成了数万人的感染及数千人的死亡【1】。
病毒污染恶性件造成严重后果的同时也促成了血液制品病毒安全保障的提升,检测技术的进步使某些客观存在的病毒能够被检出发现。随着人类对病毒认知的提高,检测技术进步和病毒去除及灭活技术的开发运用,病毒安全得以提高。但人类对病毒的认知依然相对有限,一些新出现的病毒也会成为人类需要面对和解决的问题。因此,病毒污染防控工作是保障生物制品安全性的重要工作内容。
哺乳动物细胞生产体系
病毒污染事件概览
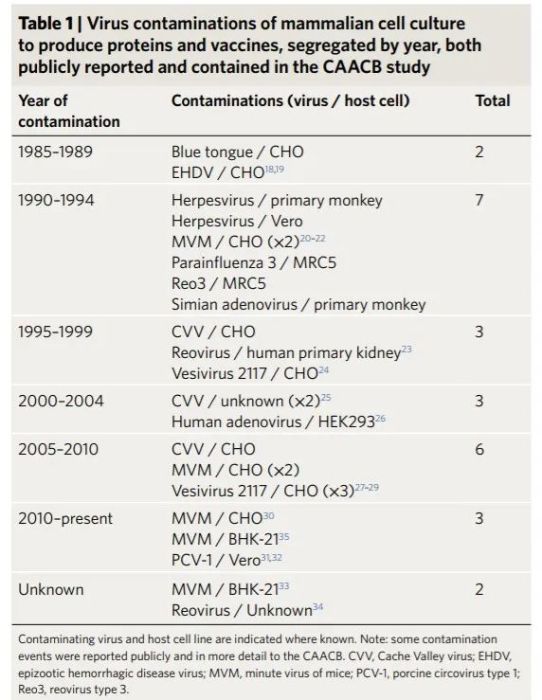
根据CAACB(Consortium on Adventitious Agent Contamination in Biomanufacturing)统计,虽然在过去的30多年间,协会统计的20多家生物技术企业哺乳动物生产体系的病毒污染事件发生的数量为26起,这些污染事件大多数涉及的是基于CHO的生产工艺,但也有发生在其他生产系统中的情况,比如基于人类细胞或非人类灵长类细胞的生产工艺。尽管数据表明,生物制品生产过程中产生污染是罕见事件,但却是可能存在真实的风险,因为它可以产生严重影响,导致需要接受治疗的患者因药物短缺而受到影响,由污染事件引起的调查、清洁、纠正措施、销售损失和生产车间停工等,会导致巨大的经济损失。因此,病毒安全是启动药品生产时的一项重要内容和重要质量属性【2】。2009年, Genzyme公司发生Vesivirus 2117污染培养基,导致了17.5亿美元的罚款,约10-30亿美元的产品销售额损失【1】。
生物制品病毒安全性相关
法规概览

中国:
中国药典三部. 生物制品生产检定用动物细胞基质制备及质量控制
中国药典三部. 生物制品病毒安全性控制
中国药典三部. 生物制品生产用原材料及辅料质量控制
欧洲:
European Pharmacopeia. Tests for extraneous agents in viral vaccines for human use. Chapter 2.6.16
European Pharmacopeia. Cell substrates for the production of vaccines for human use. Chapter 5.2.3
Guideline on Virus Safety Evaluation of Biotechnological Investigational Medicinal Products. EMEA/CHMP/BWP/398498/2005
FDA:
Guidance for Industry. Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications. U.S. Food and Drug Administration Center for Biologics Evaluation and Research. 2010
Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use. FDA CBER. 1997
日本:
Japanese Pharmacopoeia. Basic Requirements for Viral Safety of Biotechnological/Biological Products listed in Japanese Pharmacopoeia
ICH:
Quality Guideline Q5A(R1): Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin; International Conference on Harmonisation: 1999
Quality Guideline Q5D: Derivation and Characterisation of Cell Substrates Used for Production of Biotechnological/Biological Products; International Conference on Harmonisation: 1997
WHO:
Recommendations for the evaluation of animal cell cultures as substrates for the manufacture of biological medicinal products and for the characterization of cell banks. Revised 2010, TRS 978 (2013)
保证药品病毒安全的基本原则
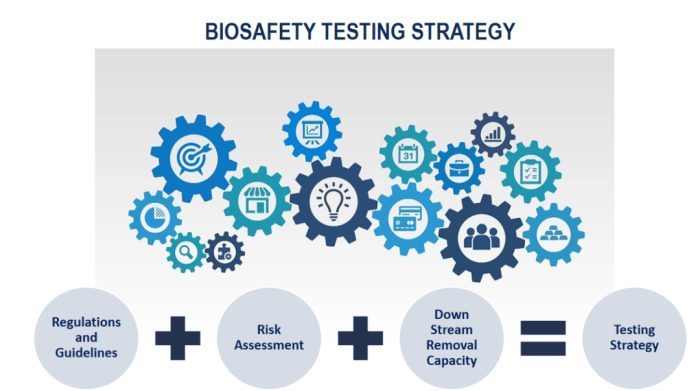
1. 预防: 对细胞系和其他原料(包括各种培养基)进行选择和检测
2. 清除:对生产工艺中清除感染性病毒的能力进行评估
3. 检测:在生产的适当步骤对产品进行病毒检测,确保产品未受感染性病毒的污染
生物制品病毒检测的现行方法
1.外源病毒
体外指示细胞法:
体外外源因子检测所需的多种指示细胞系需要根据生产用细胞系的历史和物种进行选择。
根据ICH和EU指南,测试中所用指示细胞需根据待试细胞库的物种来源而定,但必须包括对人病毒敏感的人和/或非人灵长目动物细胞系,以确保能较为广泛的检测到人和有关动物的病毒。
体内动物接种法:
最常用于接种样品的是鸡胚、小鼠和豚鼠;接种一段时间后,检查是否有疾病或感染的症状。
2. 人源和猴源病毒QPCR法
根据ICH指南,如果用于生产的细胞系为人类或非人类灵长类动物来源,除非另有说明,否则应对人类病毒(例如引起免疫缺陷性疾病和肝炎的病毒)进行检测。
检测这些特定病毒可采用针对病毒序列的实时QPCR方法。
3.牛源性病毒
当细胞已经或可能已经暴露于牛源性材料(例如胎牛血清[FCS] 或牛血清白蛋白[BSA])时,需要进行牛源性病毒检测。
基于CFR指南的第9条,利用细胞裂解物与牛来源细胞一起孵育,并根据细胞病变效应和荧光抗体染色技术检测牛源性病毒。此外,我们可提供针对牛源性病毒的特异性PCR检测。
4.猪源性病毒
当细胞已经或可能已经暴露于猪源性材料(例如胰蛋白酶)时, 需要进行猪源性病毒检测。
基于CFR指南的第9条,利用细胞裂解物与猪来源细胞一起孵育,并使用荧光抗体染色分析检查细胞病变效应和反应性。此外,我们可提供针对猪源性病毒的特异性PCR检测。
5. 逆转录病毒及其他内源性病毒
感染性实验:细胞培养产生逆转录病毒可能是内源性逆转录病毒基因组表达(例如啮齿动物和禽类细胞)和/或实验室污染的结果。在具有复制能力的逆转录病毒充当辅助病毒的检测细胞中看到蚀斑或斑点形成的细胞培养方法通常用于检测逆转录病毒。
S+L-focus assay可检测能够感染鼠和非鼠细胞的异嗜性和兼嗜性鼠逆转录病毒。XC空斑实验(XC plaque assay)能够检测仅感染鼠细胞的单嗜性鼠逆转录病毒。
逆转录酶活性:大多数内源性和外源性逆转录病毒在细胞培养物中不会产生形态转化或细胞病变发生,因此通常不会在细胞培养物中检测到这些病毒的产生。在这些情况下,检测逆转录酶的存在可以用作检测逆转录病毒的可靠方法。可以使用产物增强性反转录酶活性测定法(PERT或PBRT)完成逆转录酶的检测。
透射电镜检查法(TEM) :透射电子显微镜(TEM)用于通过可视化和量化生物体液或细胞内的病毒颗粒来确定病毒载量。此外,它是根据病毒样颗粒的大小和形态特征对其进行表征的有用工具。
6.抗体产生实验检测特定的啮齿动物病毒
小鼠、仓鼠和大鼠抗体产生试验(分别为MAP、HAP和RAP)是通过在小鼠、仓鼠和大鼠中接种检测物品来检测病毒污染物的间接方法。采用免疫荧光和ELISA技术检测这些动物的血清中是否存在与种属特异的病毒组有反应性的抗体。
此外,还建议通过PCR或使用基于细胞的体外试验检测CHO细胞系中是否存在小鼠细小病毒(MVM)。
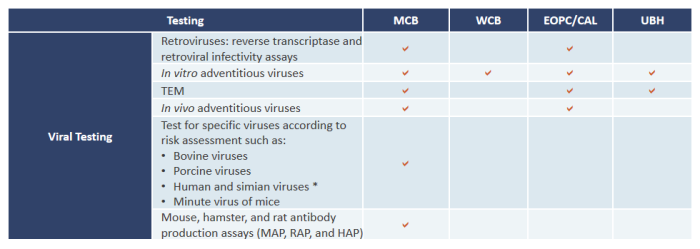
常用病毒安全性检测方案(以CHO为例):
现行方法的一些检测局限性:
对于体内体外感染法所选择的物种或者细胞系需要具备足够的易感性
感染病毒能够通过感染产生通过动物死亡、细胞病变效应等现象
如果发现病毒感染的阳性结果,需要进一步研究核实
TEM,PCR,PERT方法并不区分感染性和非感染性的病毒
病毒类疫苗的检测必须使用中和抗体中和病毒类疫苗
灵敏度有限/低:TEM (LOD :100万病毒颗粒 /ml)、抗体产生实验、免疫荧光法
PCR法只检测已知特定病毒
动物权益保护
耗时:体外感染法检测病毒(14或28天)、逆转录病毒感染性实验(28天)、体内接种法(豚鼠实验需要42天)
病毒安全性检测新方法与新趋势
此前文献报道,使用vero细胞生产减活病毒疫苗中应用传统方法未检测出病毒污染物。但通过NGS检测出了猪圆环病毒。因为实验动物没有出现相关症状,细胞也未产生细胞病变效应,TEM也未发现,现幸运的是,人类不会感染这类病毒【3】。
类似的案例也在昆虫细胞中发现,通过NGS方法检出了此前方法未检出的弹状病毒【4】。
目前有一些新兴技术,正在逐渐应用于病毒的检测,如NGS(二代测序)、简并 PCR、DNA芯片、多重PCR联合核酸质谱分析技术等。其中NGS展示出很强的优势。NGS作为大规模平行测序,可测定DNA 或RNA序列,不同于常见的PCR或qPCR方法需要已知靶向的序列,NGS技术具有不需要任何序列信息的优势,因此,NGS原则上可以检测和鉴别样本中的所有序列。NGS方法可以检测病毒储备液,例如毒种或病毒载体;也可用于检测细胞基质内源性和整合病毒;应用转录组测序可用于检测细胞基质激活的复制病毒,与其他方法相比,其检测广度最高、灵敏度高,与PCR方法相当,它能检测到活跃复制的病毒。
ICH Q5A指南是最常使用的生物安全检测指南,当前版本于1999年开始使用,至今已逾20年。几年前,FDA提出了一项修订方案,新版Q5A(第2版)将把工艺验证中的程序纳入考虑并纳入新型产品,新型产品包括疫苗、病毒样颗粒(VLP)和基因治疗产品,修订工作也将考虑生产技术的进步、新兴的病毒检测分析方法和现有的科学知识,比如可能将NGS等技术替代体内方法,以获得更灵敏的结果和减少动物的使用等。
参考资料
【1】治疗用生物制品病毒污染风险控制要点.中国医药科技出版社,2021.1
【2】Viral contamination in biologic manufacture and implications for emerging therapies.Nature Biotechnology,2020
【3】Viral nucleic acids in live-attenuated vaccines: detection of minority variants and an adventitious virus.J Virol. 2010 Jun;84(12):6033-40
【4】Identification of a Novel Rhabdovirus in Spodoptera frugiperda Cell Lines. J Virol. 2014 Jun;88(12):6576-85
本文来源于Charles River
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多