浅析纳米晶技术在新药领域的开发应用
直以来,API溶解度差、生物利用度低是困扰药物研发人员的一大难题,因溶解性低,导致其制剂开发形式受限,给制剂科研人员带来了很大的挑战,当然,它也会很大程度影响临床疗效从而严重限制其进一步的开发与临床应用。作为一名制剂研发人员,就是要想尽一切办法利用制剂手段将“不可能”变为“可能”,当然,巧妇难为无米之炊,还是要借助新技术、新辅料、新设备。
纳米技术的兴起给难溶性药物开发带来了曙光,将纳米技术与药学相结合, 从而衍生出纳米药物,即药物与辅料制成的粒径1 ~1 000 nm 的载药纳米粒( 如纳米粒、纳米脂质体、纳米乳) 或纳米药物晶体(drug nanocrystals,即药物本身纳米化)。载药纳米粒是指将药物包裹或吸附于载体中(载体可以为脂质体、纳米金、胶束等),该方法制备工艺较为复杂,且存在载药量低、稳定性差等问题;而药物纳米晶体技术是纯药物纳米胶态分散体系, 药物本身纳米化,不需要载体材料负载, 制备工艺简单, 载药量高。过去30年纳米晶体技术在药剂学领域取得了巨大的发展,制备技术方法不断升级更新,据国内外报道已显示了多种纳米晶体在临床上的广泛使用,例如抗癌药、抗真菌药、激素类药物、抗炎类药物等,且作为中间制剂技术可作用于多种给药形式,如口服、胃肠道给药、肺部给药、注射和眼部给药等。
纳米晶体技术为改善难溶性药物的给药提供了一种可行性技术方法。该技术将药物粒径降低至纳米级,当药物以纳米尺寸存在时,改变药物的性质亦可发生“翻天覆地”的变化,可高效的提高难溶性药物的溶解度和溶出速率,减少给药体积、降低毒副作用,从而提高生物利用度和临床疗效。例如2000年我国上市的第一个纳米药物制剂---西罗莫司片,生物利用度比液体制剂(脂质体口服)高出21%,不用冷藏保存,服用更为方便。但是纳米晶药物粒径减小又带来一大难题即小粒径的粒子处于高能状态,表面自由能增大,粒子之间会产生相互聚集;同时纳米粒子强烈的布朗运动加剧了粒子之间不断相互碰撞,加速了聚集、结块、晶体生长或转晶的可能性,因此在制备纳米晶的过程中会加入1种或几种稳定剂(结晶长大抑制剂)。一些常用的稳定剂包括:聚维酮、磷脂、聚山梨醇酯、泊洛沙姆、纤维素或阴离子表面活性剂。稳定剂的作用机理主要是通过离子之间的静电排斥作用或空间障碍作用从而保持纳米体系稳定。
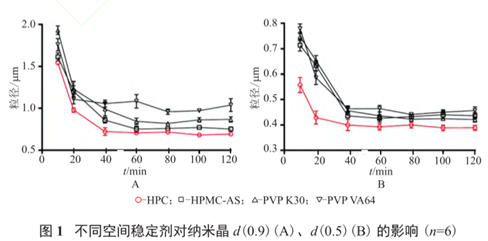
例如布洛芬纳米晶制剂制备中,选择SDS为离子稳定剂,HPC、HPMC-AS、PVP K30、PVP VA64等高分子辅料作为空间稳定剂,考察不同组稳定剂对产品粒径的影响。结果显示HPC作为空间稳定剂,药物颗粒粒径稳定效果最好,故选择HPC-SDS为组合稳定剂。
纳米晶体的制备方法主要有Bottom up和Top Down两种方法。Top Down法又称为分散法,是借助研磨或均质等机械力作用使药物粒径分散减小。主要包括介质研磨法和高压均质法。该方法工艺重现性好,易于工艺方大及进一步产业化,是纳米晶制备的常用手段。
介质研磨法又可分为湿法研磨和干法研磨两种。湿法研磨是将药物和稳定剂等高分子材料按处方量在水中混匀,然后加入介质研磨机中,介质研磨机中需提前加入研磨介质(研磨介质一般用钢珠、玻璃珠、陶瓷珠、氧化锆、玛瑙等),仪器启动后借助药物颗粒、研磨介质和器壁之间产生强烈的相互碰撞和剪切力,以致固体颗粒粒径逐渐减小至纳米级别,当粒径小于研磨腔分离器滤网间隙大小时,将被离心力挤出研磨腔至料缸内,间隔一定时间实时监测粒径的变化,若未达要求则重复循环研磨,直至粒径达到所需要求为止。干法研磨是将药物和稳定剂直接干法混合研磨获得所需粒径的纳米晶。干法研磨比较大的一个缺点就是制备过程中容易造成粉尘、黏附器壁等,不利于产业化;而湿法研磨制得的纳米晶体药物稳定,容易进行下一步的后处理。
一般来说,关键物料属性CMA(API浓度、API初始粒径、稳定剂的种类及加入量)、关键工艺属性CPP(研磨介质的材质、微珠的粒径、物料循环的流速、循环时间、进料量、温度)等均会对纳米晶的关键质量属性(粒径分布及变化、物理稳定性、晶型、ζ电位、化学稳定性)等产生一定影响,所以在制备过程中,要实时监控这些参数可能发生的变化,有利于制备出粒径符合要求且稳定的纳米晶药物。一般在制备过程中,选择适宜的API浓度、尽量降低API的初始粒径、选择适宜的稳定剂及量、微珠粒径选择合理(微珠粒径越小,同等重量下数量和接触点越多,碰撞频率越高,碾磨效果越好)、转速设置合理(转速越高,粒子运动越快,则碾磨效率越高),控制这些条件就可以制得比较理想的纳米晶药物。
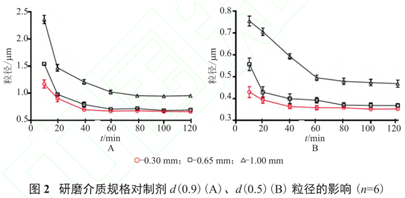
例如布洛芬纳米晶制备过程中,考察3种不同规格氧化锆珠(d=1.00、0.65、0.30mm)对研磨效果的影响。随着研磨时间延长,3种规格的粒径趋势走向平缓,60min差不多达到该研磨体系的最小粒径。选择0.3mm研磨珠时,可在较短时间达到更小粒径,故选择0.3mm研磨珠作为研磨介质。
该方法被认为是纳米晶药物制备的第二大常用技术。该方法的作用原理是:API+稳定剂混悬液被高压泵导入可调缝隙的均质阀,瞬间失压的物料以极高的流速喷出,碰撞在阀组件之一的碰撞环上,产生高速剪切、撞击和空穴三大效应,达到细化和均质的作用。该方法制备得到的纳米晶药物粒径较小、粒度分布较窄,重现性好。关键物料属性CMA(API均质前的初始粒径、API浓度、稳定剂种类及用量等)和关键工艺属性CPP(均质压力、循环次数)会直接影响纳米晶药物的质量属性,可能会影响最终制得纳米晶的粒径、ζ点位、晶型、溶出结果等。
又称之为反溶剂沉淀法,是将药物首先溶解于一种良溶剂中,然后再将其加入另一种可与之混溶的不良溶剂中,通过溶剂的改变使得药物浓度过饱和而析出,通过控制晶核形成和生长的速度来得到纳米级尺寸的纳米药物晶体。该方法制备过程简单,实验成本低,易于工艺方大,但缺点亦很明显,试验过程中使用了有机溶剂,容易造成有机溶剂残留而导致毒性问题等。在该方法中,晶核的诱导形成和生长是析晶过程中的关键限速步骤。图(a)为结晶诱导阶段;(b)-(c)晶核形成期;(c)-(d)晶核生长期;而稳定剂的种类及浓度、结晶温度、溶剂的选择种类及溶度等都是影响晶核成长的关键质量属性,一般来说晶核形成的越多,结晶粒径就越小,反之则相反。

图示:偏振光显微镜下观察到的晶核与结晶大小随时间的变化
通过Bottomup或Top Down方法所制得的纳米晶药物仅仅是一种制剂中间体,制备结束后往往以液态形式存在,而我们需要将其做进一步处理,将其进一步转化为口服固体制剂(片剂 or 胶囊剂),这么做的目的是为了提高药物的稳定性,提高患者用药的依从性和治疗疗效。所以如何将其有效的转化为常用的片剂或胶囊剂型就是研发的一个难点问题。
想要开发出理想的片剂或胶囊剂型,前提是要保证纳米晶中间体保持良好的物理、化学稳定性:纳米晶中间体在一定时间内必须保证粒径大小保持不变且粒径分布越窄越好;且在其制备过程中及制备完成后的放置时间内,均具备可控的含量及杂质等。那通过控制稳定剂的处方筛选、控制纳米晶制备工艺参数及冷却效率以及在创新药研发初期,控制辅料与API的相容性研究等手段均可以最大程度的保证纳米晶中间体的良好物理化学稳定性。
接下来如何将纳米晶中间体成功转化稳定的固体制剂呢?喷雾干燥、流化床顶喷制粒及包衣技术是常用手段。当然,纳米晶药物转化为固体制剂制剂工艺难度程度较普通制剂要高一些,首先,纳米结晶药物多为载药量高的混悬液中间体,并加入大量辅料保证其物理稳定性,因此粘度及固含量都较高。增重比例高使得工艺过程耗时长,参数变化大;其次,若选择流化床湿法制粒,可能会造成纳米晶药物遇湿发生聚集、影响粒径等;而如果选择干法制粒,那压轮压力不当亦可能会改变纳米颗粒的结构、若做成片剂,那压片机压力调节不亦会影响晶体结构等......有些产品为了避免压片压力等对晶体造成影响,会选择颗粒灌胶囊来减小压力对纳米颗粒的影响,也有些产品将纳米结晶中间体以包衣形式包裹在空白片芯表面而完全避免压力的产生。所以在研发前期阶段还是尽可能详细的去摸索制剂处方工艺,包括关键物料属性、关键工艺参数、关键质量属性都要做详细的考察和摸索,无疑增加了研发人员的工作量,但是毫无退路可言,制剂研发人员只能挑起重担奋力前行开辟道路,终归会“突破重围”,迎来胜利曙光。
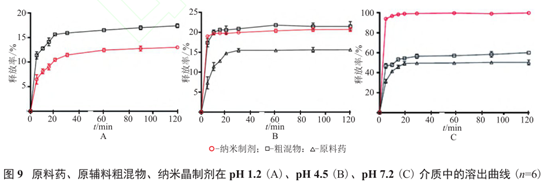
例如:布洛芬晶体制备研究中,将0.2gAPI、原辅料粗混物、纳米晶分别投入900ml的pH1.2、4.5和7.2介质中考察溶出曲线,结果得知:PH7.2介质中,纳米晶能够在10min内完全溶出,原辅料粗混物和API在2小时内仅分别溶出60.4%和30.7%,进一步说明粒径的优化减小可增强药物的溶解度,提高溶出速率。
综上,虽然纳米晶技术可有效改善药物的溶解度,提高患者生物利用度,拥有非常广阔的发展前景,但是必须意识到该技术尚未完全成熟,仍具有待完善之处,例如纳米晶在胃肠液中处于一种高能状态,属于热力学不稳定体系,如果处方中没有结晶抑制剂或种类、浓度选择不当,虽然药物也可以很快析出结晶,但是它会很快通过进一步聚集、结块等迅速让自身能量降低,达到一种稳定的低能态,该现象就好比是弹簧过程;而如果处方中含有选择合理的高分子结晶抑制剂,药物的结晶析出就会很慢,好比是降落伞,能量下降也很缓慢,从而保持较长时间的超饱和浓度使纳米晶药物维持良好稳态。基于此,我们需要进一步加强研究关于影响纳米晶药物制备及稳定的关键因素,努力优化纳米晶制备工艺,进一步缩小粒径、提高纳米晶药物的稳定性,同时也要深入研究探讨纳米晶药物的体内外相关性和安全性评价等。当然,我们最终的目的还是要回归初心:通过制剂手段,提高药物溶解度,给患者带去更好的疗效。
3. 纳米药物晶体技术:改善难溶性药物溶解度的“及时雨”

















评论
加载更多