JAK抑制剂:从爆发到瓶颈到新希望
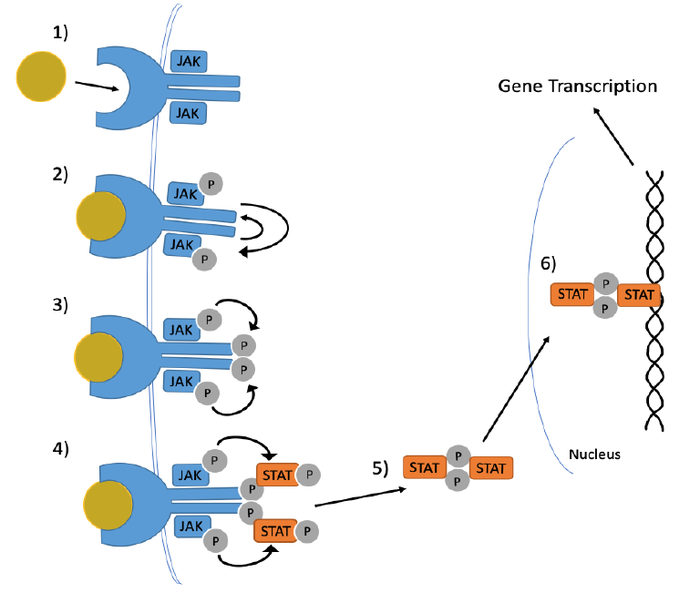

JAK/STAT信号通路及相关疾病

JAK抑制剂
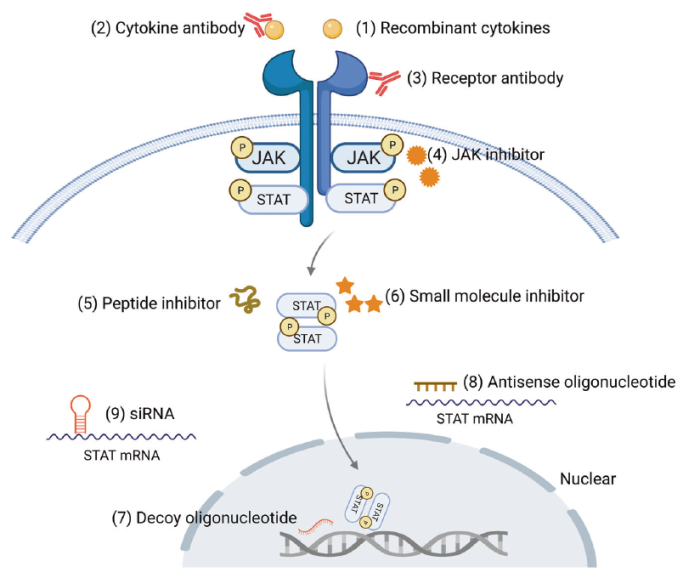
图2 JAK/STAT通路的众多治疗靶点
(来源:The JAK-STAT signaling pathway: from bench to clinic)


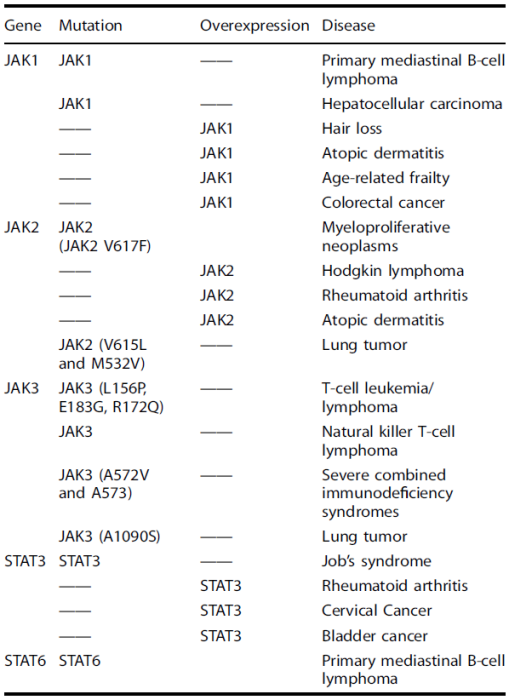
表2 JAK抑制剂的临床研究进展
(来源:The JAK-STAT signaling pathway: from bench to clinic)
另一种是开发JAK抑制剂的局部疗法。例如JAK1/3抑制剂ATI-1777能选择性地作用于肠道,而全身作用很小。JAK3/SYK2/ARK5多靶点抑制剂OST-122也是一种肠道选择性药物,目前处于2期临床阶段,用于治疗溃疡性结肠炎(UC)。

JAK1全长结构的进展
最近,Science发表了JAK1激活状态下的完整结构(EMDB ID: EMD-25715,图4为模式图),促进了对细胞因子和致癌突变驱动信号激活的理解。JAK1与IFNλR1的二聚体结构显示,激活后的JAK1二聚体通过PK结构域产生相互作用,而FERM-SH2结构域则承担了与受体作用的角色。
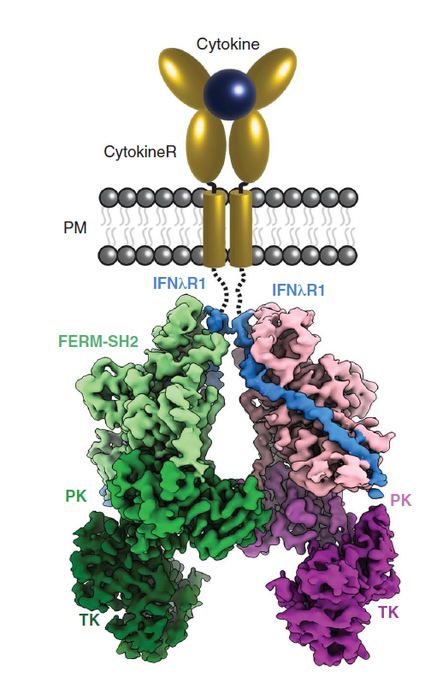
结合先前的研究,作者还提出了JAK激活的两步变构模型(图5)。当JAK活化前,PK结构域处于自我抑制的状态,只有发生变构后才能形成二聚体。
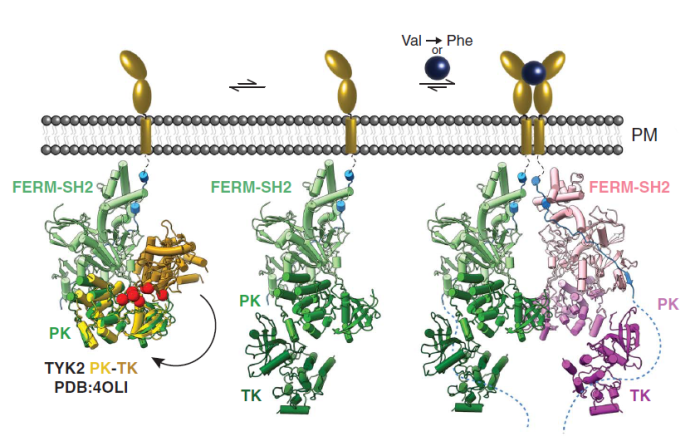
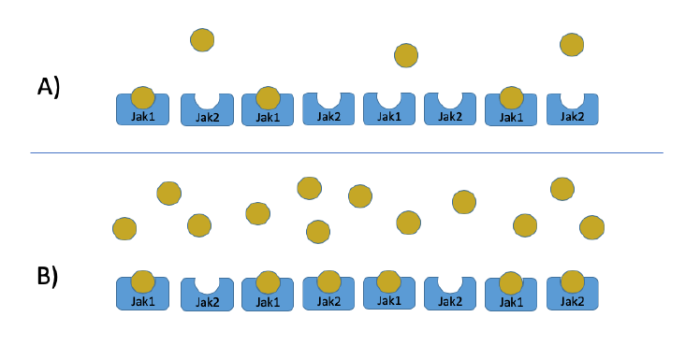
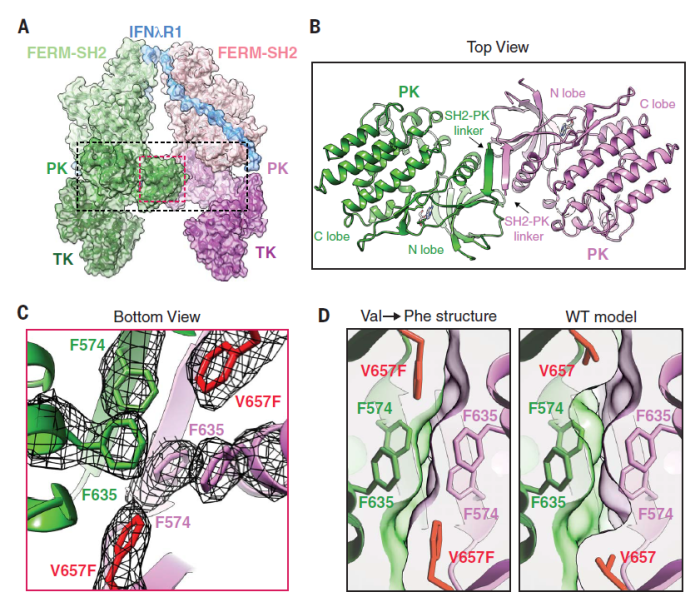
许多研究表明,Val→Phe突变能引起骨髓增生性肿瘤(MPN),而该突变就位于PK-PK二聚体界面,突变提高了PK之间的形状互补性和疏水相互作用(图6),使得JAK在没有受体信号时也能发生二聚。这一发现阐述了JAK激酶可能的一种致癌机制。此外,该发现对于药物研发也具有重要的指导意义。目前治疗该突变疾病的药物都具会产生耐药,原因是异源二聚化中如果抑制了其中一种JAK,另一种仍可能发生突变,因此如果设计出直接针对该突变的疗法,则可以避免这一问题,同时还能避开正常JAK。
总结
JAK抑制剂发展到如今已经有不少药物上市,在自身免疫疾病和肿瘤领域占有一席之地。但以往的JAK抑制剂大多以ATP竞争性药物为主,难免产生很多副作用。随着对JAK激活机制的进一步理解,抑制剂的开发又开辟了新的道路,让我们一起期待下一个大爆发吧。
参考文献
[2] McLornan DP, Pope JE, Gotlib J, Harrison CN. Current and future status of JAK inhibitors. Lancet. 2021 Aug 28;398(10302):803-816. doi: 10.1016/S0140-6736(21)00438-4.
[3] Luo Y, Alexander M, Gadina M, O'Shea JJ, Meylan F, Schwartz DM. JAK-STAT signaling in human disease: From genetic syndromes to clinical inhibition. J Allergy Clin Immunol. 2021 Oct;148(4):911-925. doi: 10.1016/j.jaci.2021.08.004.
[4] Levine RL, Hubbard SR. Unlocking the secrets to Janus kinase activation. Science. 2022 Apr 8;376(6589):139-140. doi: 10.1126/science.abo7788.
Glassman CR, Tsutsumi N, Saxton RA, Lupardus PJ, Jude KM, Garcia KC. Structure of a Janus kinase cytokine receptor complex reveals the basis for dimeric activation. Science. 2022 Apr 8;376(6589):163-169. doi: 10.1126/science.abn8933.
本文来源于BiG生物创新社
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多