ADC药物的耐药机制
一、ADC的作用机制
抗体偶联药物(ADC)进入体内后,抗体部分与肿瘤细胞表面的靶向抗原结合 ,肿瘤细胞会将 ADC 分子内吞。其中一部分能够与内体中的 Fc 受体结合,从而一部分 ADC 被转运到细胞表面并通过FcRn介导的转胞吞作用释放到胞外,而其他ADC-抗原复合物则进入溶酶体,溶酶体中的酶或者酸性环境可降解ADC,从而释放出有细胞毒性的化学药物,破坏 DNA 或阻止肿瘤细胞分裂,起到杀死肿瘤细胞的作用。
ADC结构的任一组分发生异常或在周期性治疗压力下都会导致耐药性的产生。ADC的耐药机制可能包括:ADC暴露压力过大;靶点抗原下调、缺失或抗原基因突变;内化途径的缺失;溶酶体蛋白水解功能降低;溶酶体转运蛋白突变;细胞周期停滞;药物外排转运蛋白表达异常;下游信号通路被激活;凋亡失调等等。
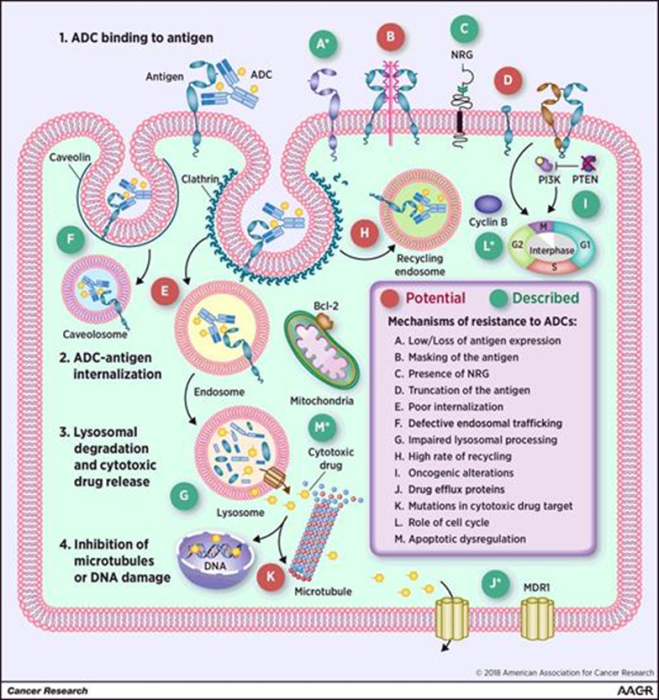
图片来源:Resistance toAntibody–Drug Conjugates. Cancer Res 1 May 2018; 78 (9): 2159–2165.
多次暴露ADC会诱导肿瘤细胞产生耐受。例如:多次暴露于抗HER2的Trastuzumab-emtansine(T-DM1),会使HER2阳性乳腺癌细胞系对T-DM1产生抗性。这也是目前构建ADC耐药小鼠模型的常规实验手段。
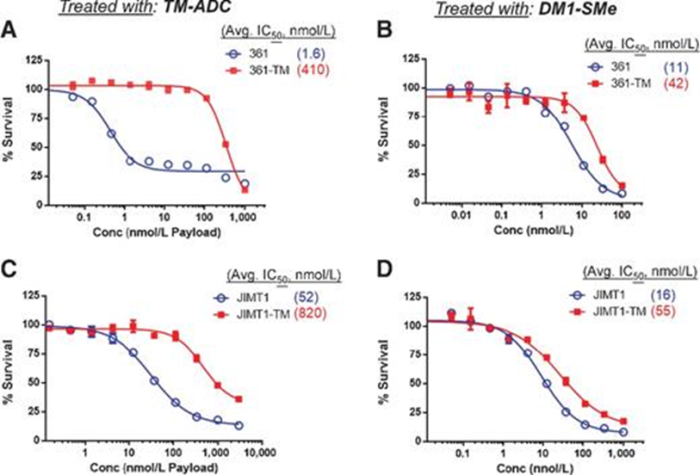
用 TM-ADC和纯药物DM1-SMe处理的亲代细胞和耐药细胞的细胞毒性特征
图片来源:Mol Cancer Ther. 2015 Apr;14(4):952-63.doi: 10.1158/1535-7163.MCT-14-0862. Epub 2015 Feb 2. PMID: 25646013
矛盾的是,高抗原表达也可能会降低 ADC 的有效性。这种情况主要发生在Gemtuzumab ozogamicin(Mylotarg®),外周血中高 CD33 抗原负荷是一个独立的不良预后因素,Gemtuzumab 静脉输注导致外周血中CD33 完全饱和,与相应外周血样本中的 CD33 饱和度(>90%)相比,骨髓中的 CD33 饱和度显著降低(40-90%)。显然,血液中的高 CD33 抗原负荷会消耗吉妥珠单抗,从而限制其渗透到骨髓中。这可能也是Gemtuzumab ozogamicin仅在大约 30% 的复发性 AML 患者中诱导缓解的原因。
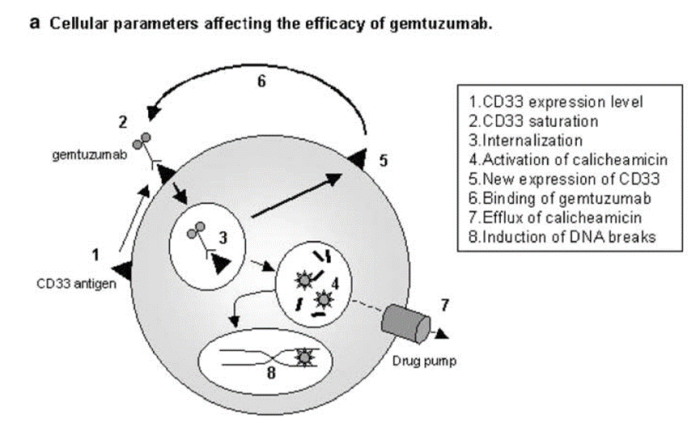
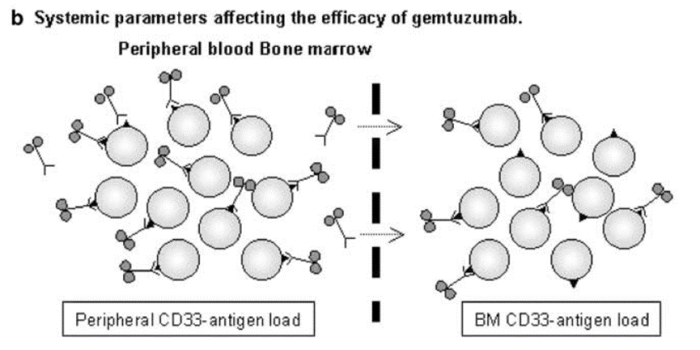
图片来源:HighCD33-antigen loads in peripheral blood limit the efficacy of gemtuzumabozogamicin (Mylotarg) treatment in acute myeloid leukemia patients. Leukemia.2004 May;18(5):983-8. doi: 10.1038/sj.leu.2403350. PMID: 15029214.
抗原胞外域的截断或细胞外基质成分的掩蔽可能与 HER2对曲妥珠单抗的耐药机制有关。过表达 HER2 的肿瘤亚组也表达 p95HER2,这是一种具有激酶活性的氨基末端截短受体。在 46 名接受曲妥珠单抗治疗的 HER2 过表达晚期乳腺肿瘤患者的样本中,通过免疫荧光评估 p95HER2 的表达。显示了 p95HER2与曲妥珠单抗耐药性直接相关( P = .029,使用双边卡方检验计算)。

图片来源:Expression of p95HER2, a truncatedform of the HER2 receptor, and response to anti-HER2 therapies in breastcancer. J Natl Cancer Inst. 2007 Apr 18;99(8):628-38. doi: 10.1093/jnci/djk134.
抗原配体的存在可能影响对ADC的敏感性。研究表明,促进 HER2 与 HER3 和 HER4 异二聚化的配体(如神经调节蛋白NRG-1β)会削弱 T-DM1 的功效。NRG-1β 对HER2 扩增的乳腺癌细胞系中 T-DM1 活性的影响(如下图)。A、BT-474、SK-BR-3 和ZR-75-30:NRG-1β (2 nmol/L)几乎完全抑制 T-DM1活动(左)。右图显示 NRG-1β 对 T-DM1 活性的剂量依赖性降低。
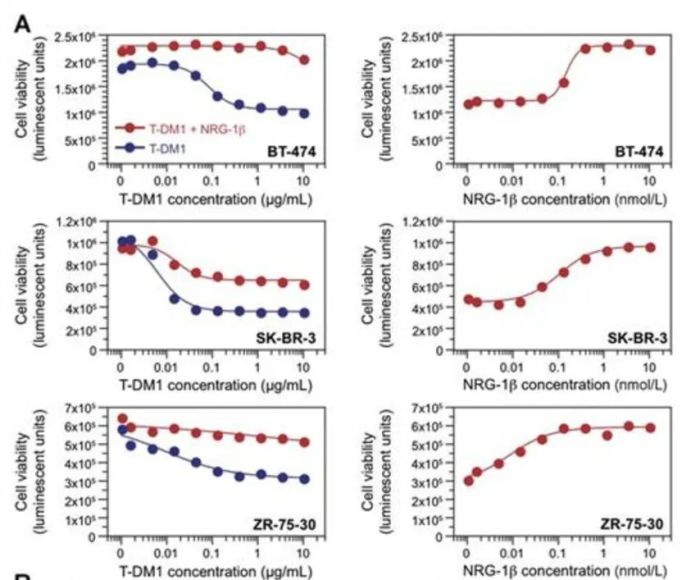
图片来源:Dualtargeting of HER2-positive cancer with trastuzumab emtansine and pertuzumab:critical role for neuregulin blockade in antitumor response to combinationtherapy. Clin Cancer Res. 2014 Jan 15;20(2):456-68. doi:10.1158/1078-0432.CCR-13-0358. Epub 2013 Oct 4. PMID: 24097864.
四、内化和转运至溶酶体途径缺陷
抗体与靶点结合后被内吞到细胞中。内吞作用可以通过不同的内化途径发生,例如网格蛋白介导 (CME)、小窝蛋白介导和网格蛋白-小窝蛋白非依赖性内吞作用。据报道,CME 是各种 ADC 采用的中心路线。
五、溶酶体功能障碍
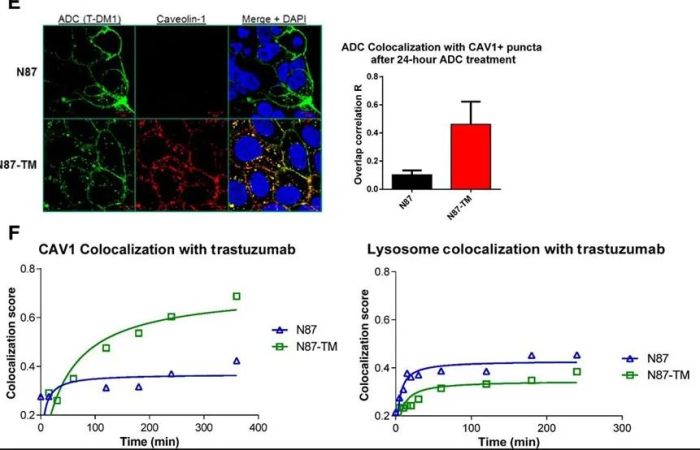
ADC需要到达溶酶体,然后细胞毒剂通过化学或酶促切割释放。在长期暴露于药物而对 T-DM1 产生抗药性的细胞中,已观察到T-DM1在溶酶体积累。在这些细胞中,药物到达溶酶体区室,但蛋白水解活性低于敏感细胞中的蛋白水解活性。这种缺陷是由于溶酶体 pH 值升高,这反过来又抑制了溶酶体蛋白水解酶活性。
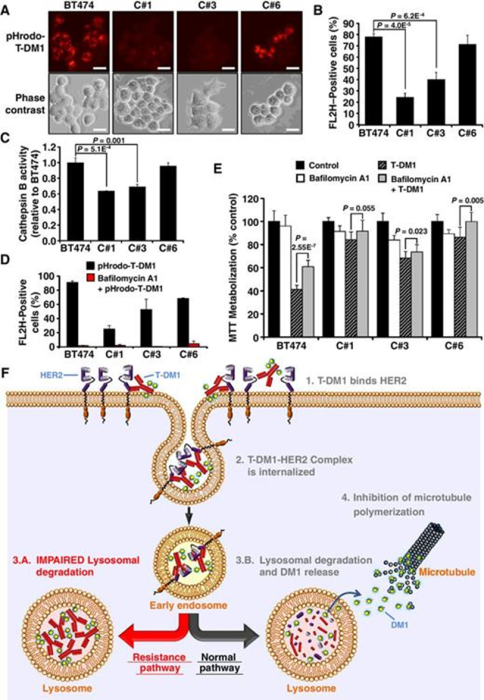 图片来源:Resistance to the Antibody-Drug Conjugate T-DM1 Is Based in aReduction in Lysosomal Proteolytic Activity. Cancer Res. 2017 Sep1;77(17):4639-4651. doi: 10.1158/0008-5472.CAN-16-3127. Epub 2017 Jul 7. PMID:28687619.
图片来源:Resistance to the Antibody-Drug Conjugate T-DM1 Is Based in aReduction in Lysosomal Proteolytic Activity. Cancer Res. 2017 Sep1;77(17):4639-4651. doi: 10.1158/0008-5472.CAN-16-3127. Epub 2017 Jul 7. PMID:28687619.
对 ADC 耐药的另一种机制与细胞毒剂从溶酶体腔转运到细胞质有关。这与不可切割接头的 ADC 具有相关性,ADC的分解代谢会释放连接在氨基酸残基上的接头-细胞毒剂。溶酶体膜对这些分解代谢物是不可渗透的,需要运输机制将它们从溶酶体腔运输到胞质中。
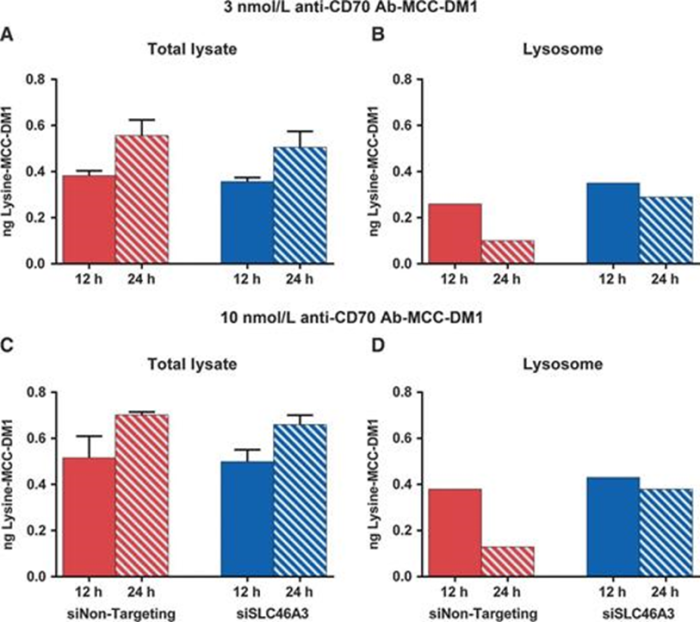
图片来源:SLC46A3 Is Required to Transport Catabolites of NoncleavableAntibody Maytansine Conjugates from the Lysosome to the Cytoplasm. Cancer Res.2015 Dec 15;75(24):5329-40. doi: 10.1158/0008-5472.CAN-15-1610. Epub 2015 Dec2. PMID: 26631267.
由于ATP 结合盒式转运蛋白(ABC)的过度表达,药物从细胞中排出,抑制了抗癌剂的细胞毒性作用,这是人类恶性肿瘤多药耐药 (MDR) 的主要原因。这些药物外排泵也可能导致对 ADC 的耐药性,因为许多细胞毒剂是 ABC 转运蛋白的底物。
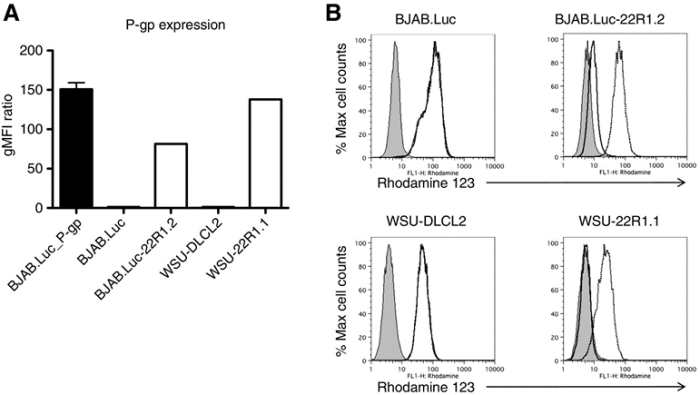
图片来源:A Novel Anti-CD22 Anthracycline-Based Antibody-Drug Conjugate (ADC)That Overcomes Resistance to Auristatin-Based ADCs. Clin Cancer Res. 2015 Jul15;21(14):3298-306. doi: 10.1158/1078-0432.CCR-14-2035. Epub 2015 Apr 3. PMID:25840969.
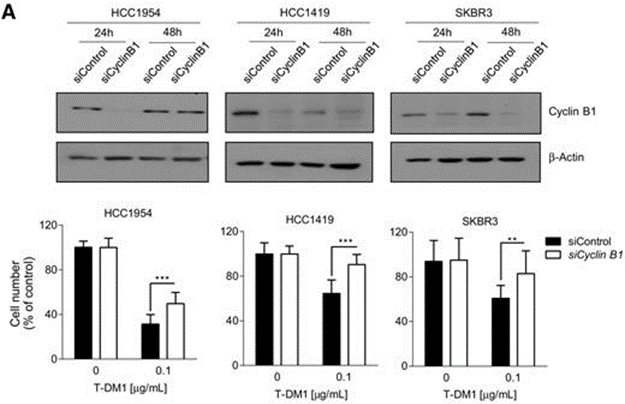
细胞周期蛋白 B是一种参与 G2-M 转变的细胞周期蛋白,细胞周期蛋白 B 的沉默导致对药物的耐药性。有研究观察到,在对T-DM1 敏感的 HER2 + 乳腺癌细胞中,该药物导致细胞周期蛋白 B 的增加,而在对 T-DM1 产生抗性的细胞中没有观察到这种增加。有研究者用针对细胞周期蛋白B1 mRNA的siRNA转染细胞系,发现细胞周期蛋白B1水平显著低于sicontrol;通过测定细胞活力发现沉默细胞周期蛋白B在三个亲本细胞系中诱导了对 T-DM1 的显著抗性(图A)。
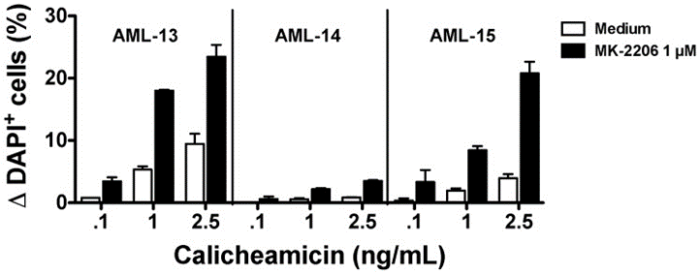
激活的 PI3K/AKT 信号传导可能会产生ADC抗性。AKT小分子变构抑制剂 MK-2206使耐药细胞对gemtuzumab ozogamicin(GO)或游离加利车霉素变敏感。一项临床研究目前正在探索 T-DM1 与 PI3K 抑制剂组合的安全性和早期疗效迹象(NCT02038010)
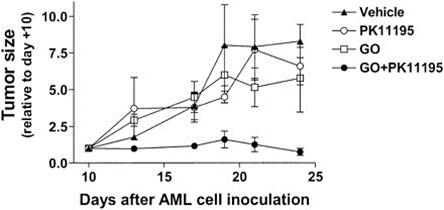
凋亡情况的变化也可能调节对 ADC 的敏感性。抗凋亡蛋白 BCL-2 和 BCL-X 的过表达与gemtuzumab ozogamicin(GO)抗性有关,有研究表明PK11195 可以增加表达抗凋亡蛋白和药物转运蛋白的 AML 细胞中的 GO 细胞毒性。并发现 PK11195 可以在小鼠模型中安全地增加 GO 的抗白血病活性;另外,Oblimersen 选择性靶向 Bcl-2 mRNA,在临床前研究中显示可增强各种抗白血病药物(包括GO)的凋亡活性;在 NHL 细胞系中,Dornan 及其同事发现 BCL-XL 的表达水平与抗 CD79b-缬氨酸-瓜氨酸-MMAE 敏感性降低相关。体内数据显示,BCL-2 家族抑制剂 ABT-263 增强了 ADC 的活性。
十、总结
药物耐受性仍然是肿瘤学中的一个主要问题,ADC的结构提供了修改其部分组件以开发能够克服耐药性的新化合物的可能性。除了一些已充分描述的机制(例如药物外排泵)外,人们对潜在耐药性的分子机制知之甚少。最近有研究描述了与 ADC 的细胞生物学相关的新的可能耐药机制,这为治疗恶性肿瘤带来了启示。ADCs 未来的临床开发可能更偏向于对耐药机制的研究和最佳药物的筛选,以最大限度地提高其治疗效果。
文章来源:药时代
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多