制药过程中造粒的方法大全
制粒是利用粉末团聚技术使微粒增大的过程,是制剂(如:大多数片剂、胶囊)过程中的一个重要操作单元。在制粒过程中,细小粉末聚集成团后称为颗粒。一般来说,制粒过程始于辅料与活性药物成分(API)初步混合,使API均匀的分布在粉末混合物中。虽然在制药工业中使用的颗粒粒径范围在0.2-4.0mm内,但它们主要粒径范围是0.2-0.5mm的中间体颗粒,这些中间体颗粒要么被包装成袋,要么与其他辅料混合后压片或装胶囊。
制粒后可增强API在最终产品中的均匀性,提高了混合物的密度,减少单位重量的体积,易于更好的储存和运输,更便于计量准确,减少在制粒过程中的粉尘、毒性药物的暴露及制粒过程中的有关危害,并改善产品的外观性状。因此,理想的颗粒特性有:圆整度高(提高颗粒流动性),粒径分布窄(提高含量均匀度),适宜的空隙率(提高颗粒可压性),适宜的水分和硬度(防止压片过程中片剂断裂和粉尘飞扬)。
制粒是改造粉粒的过程,制粒后依据药物和辅料的粒径、类型、用量、粘合剂(或溶剂)的体积、制粒时间、制粒机的种类、干燥速率(温度和时间)等因素的不同而获得不同性质的颗粒。颗粒形成的主要方法有:固体桥法、烧结法、化学反应法、结晶法、胶体颗粒沉积法。此外,粘合法也可以通过利用高粘性粘合剂的粘合作用和内聚力制粒。由粉末形成颗粒的一系列机制包括:润湿、成核、合并或增长、固化、磨损或破裂。
原辅料的混合粉末可以直接压片或通过团聚或制粒技术制成颗粒(如图1)。制粒技术大致可分为两种类型:干法制粒和湿法制粒。(图1)。干法制粒通过机械压缩(击打)或压实(辊压)的方法,促进干粉颗粒结块。而湿法制粒通过制粒溶液(粘合剂/溶剂)引发原辅料的粘合作用,促进湿软材粘附成团。这两种技术中,湿法制粒是应用最广泛的制粒技术。它涉及多个操作单元如:制软材、干燥、过筛等,这些操作过程复杂、耗时,需要较大生产场地及较多的设备。
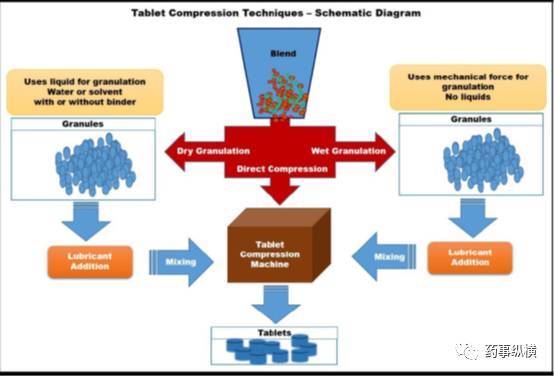
图1 片剂制备过程原理示意图
选择制粒工艺的类型时,需要深入了解药物的理化性质、辅料种类,所需颗粒的流动性和释放特性等等。几十年来制粒技术,如:碾压法、喷雾干燥法、超临界流体法、低/高剪切混合制粒法,流化床制粒法、挤出滚圆法等,已经成功地用于各种剂型的制备中。制粒技术在不断发展,各方面的改进、完善,以及新技术和工艺的开发更是促进了制粒技术的发展。本文的目的是让读者了解最新的制粒技术和工艺,同时将简要介绍这些制粒方法的发展过程,优势和局限性(已总结在表1中)。
干法制粒的最新进展
干法造粒可以通过碾压或击打的方式完成制粒过程。两种不同类型制粒方式的原理示意图见图2。与湿法制粒技术的不断进步相比,现在干法制粒技术除了一项重要的气动干法制粒技术外,并没有明显的发展,该气动干法制粒的发明者是labsoyAtacama(赫尔辛基,芬兰),其优势和局限性已总结在表1中。
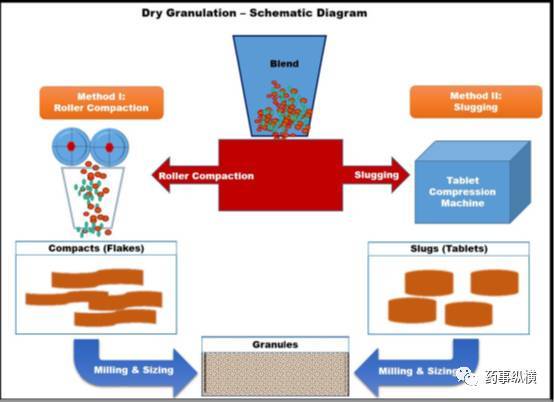
图2 干法制粒原理示意图
气流干法制(PDG)
气动干法制粒(PDG)是一项创新的干法制粒技术,它利用碾压法和气体分类法制备具有良好流动性和可压性的颗粒。在这种方法中,首先辊压机应用温和的压紧力辊压细颗粒粉末和颗粒混合物产生压实颗粒,在粉碎室中,细粉和/或更小的颗粒被夹带的气流(气动系统)从预定尺寸的颗粒中分离出来,而预定尺寸的颗粒通过粉碎室后被压缩成片剂。分离出的细粉和/或小颗粒,然后转移到分离设备(如旋风分离器),要么回到辊压机立即重新制粒(回收或再循环过程)或放置在一个容器内,稍后重新制粒以制备所需大小的颗粒。这个过程的原理示意图,见图3。
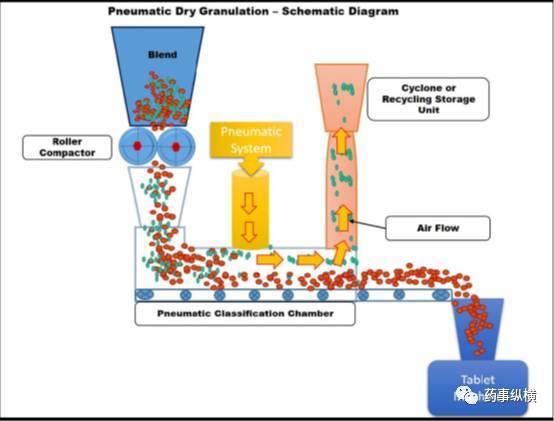
图3气动干法制粒原理示意图
PDG技术可以将任何处方的原辅料混合粉末制成流动性良好的颗粒,并且将其制成抗张强度约0.5 MPa的片剂。相比常规碾压法,PDG技术在较低的辊压力下(或低物料量时),仍能制备出流动性良好的颗粒,当载药量高达70-100%时也可以应用PDG技术制粒。此外,本方法还有其他如:制粒速度快,成本低,很少或没有物料损耗,低粉尘(密封操作)等优点。本技术主要存在:重复制粒、低剂量药物的适用性,脆碎度等问题。该技术的优势和局限性见表1。
湿法制粒的进展
湿法制粒是现在广泛应用的制粒技术,原辅料混合物与制粒溶液(有或无粘结剂)混合制湿软材后制粒。图4中列出了常规湿法制粒技术的步骤。现在湿法制粒技术已有:蒸汽制粒、水分活化干法(或湿法)制粒、热粘附制粒、熔融制粒、冷冻制粒、泡沫粘结剂或泡沫制粒、逆向湿法制粒等多项创新技术。湿法制粒技术的优势和局限性见表1。
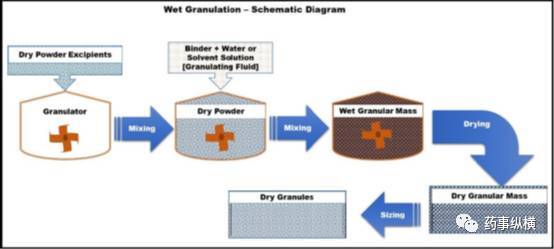
图4常规湿法制粒技术步骤示意图
逆向湿法制粒
逆向湿法制粒或反相湿法制粒是湿法造粒技术的一项新进展,将干粉浸入粘合剂液中,然后经定向粉碎形成颗粒。根据本制粒方法,首先制备粘合剂溶液,在制粒机混合过程中将干辅料粉末加入粘合剂溶液中形成颗粒。将药物与亲水性聚合物和/或粘合剂的溶液混合,形成一种药物聚合物/粘合剂浆料作为制粒溶液,然后将其他干赋形剂加入到药物聚合物/粘合剂浆料中形成颗粒。
最后,将干燥后的颗粒粉碎。该方法制备的颗粒与湿法制粒过程制得的颗粒一样具有良好的流动性和可压性。此外,与湿法制粒过程制得的颗粒相比这些颗粒压制的片剂,在溶解试验过程中具有更均匀地溶蚀现象。逆向湿法制粒过程的示意图如图5所示。
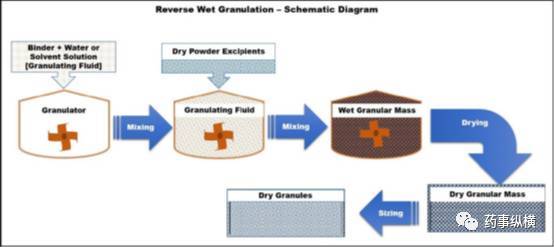
图5逆向湿法制粒过程的示意图
在逆向湿法制粒中,将大颗粒粉碎是形成颗粒的主要机制。在造粒过程中,作为润湿剂的粘结剂均匀分布,使药物充分润湿,提高了难溶性药物的溶出速度。同时也增加了药物和亲水性聚合物之间充分均匀接触的机会,使药物更好地溶解。这些改善的颗粒特性,保证了在片剂溶出过程中均匀溶蚀。
相比传统的湿法造粒技术,这种技术的优点有:形成的小球形颗粒具有良好的流动性,均匀润湿和溶蚀。由于可使药物和聚合物充分接触,这种制粒技术也适用于水溶性差的药物制粒。现有的设备,如高速剪切混合制粒机,即可做为逆向湿法制粒的制粒设备是本制粒方法的另一个优点。但是,相对于传统的湿法制粒,在粘合剂用量较低时,这种技术制备的颗粒粒径较大,空隙率低。
蒸汽制粒
蒸汽制粒是一项新型湿法造粒技术,以水蒸汽代替传统的液态水作为制粒溶液。蒸汽造粒的原理示意图如图6。蒸汽在单一组分时是透明的气体,在粉末中具有更高的扩散速率,在干燥时,更有利的去除水分。蒸汽冷凝时,水分在粉末颗粒表面形成热薄膜,热薄膜更易蒸发,因此,只需要少量的能量的就能消除多余的水分。
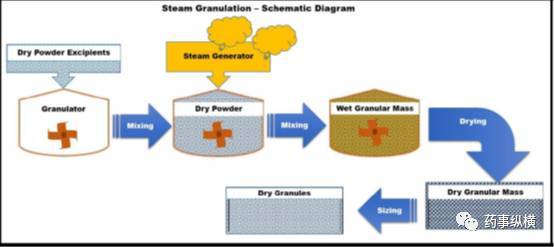
图6蒸汽造粒的原理示意图
蒸汽制粒过程的优点有:蒸汽能更好的均匀分布,并扩散到粉末颗粒中,形成具有较大的比表面积的球形颗粒,制粒时间短(没有有机溶剂);使用设备简单,如高剪切混合制粒机加上蒸汽发生器就足够了。但是这种制粒方法需要消耗大量能量以产生蒸汽。因此,并不适合所有的粘合剂及热不稳定的药物。相比传统的湿法制粒工艺,由于增加了颗粒的表面积,本方法制备的颗粒具有较高的溶解速率。
水分活化干法制粒(MADG)
水分活化干法制粒技术是一种变化的常规湿法制粒技术。使用很少的水来活化粘合剂并引发粉末结块,制粒过程可分为两个步骤:
1)粉末颗粒的润湿团聚;
2)水分吸收或分配。
通过添加少量的水(通常小于5%(1-4 %)),到药物、粘合剂和其他赋形剂的混合物中,促进其团聚成颗粒。
MADG上述两个步骤的原理示意图如图7。
当制粒溶液(水)活化粘合剂时原辅料粉末发生团聚。一旦发生团聚,向制粒机中添加吸湿性物料,如微晶纤维素,二氧化硅等,以促进其吸收多余的水分。吸湿剂从团聚湿软材中的吸收水分,导致粉料内的水分再分配,形成相对干燥的颗粒混合物。在这种水分再分配过程中,一些团聚物保持粒径大小不变,而一些较大的团聚物,可能会因破裂而导致更均匀的粒度分布。水分活化干法制粒制得的颗粒不需要干燥。
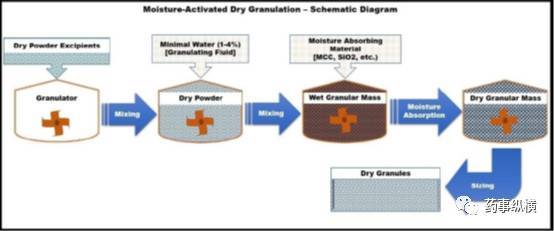
图7 MADG的原理示意图
与常规湿法制粒相比,该制粒过程使用的水量非常小,因此,不会导致较大的结块形成,团聚物的粒径主要分布在150-500µm.。此技术也被称为“润湿制粒技术”,并由此导致术语使用混乱,一些作者认为,干法制粒步骤包括将粉粒碾压或击打成块,然后将其粉碎成颗粒。而这种技术并没有使用上述步骤。考虑到这项技术利用了少量的水,使用“干法制粒”这个词并不合适。
因此,作者认为,“润湿制粒”将是这种技术的一个适当术语。润湿制粒和水分活化干法制粒是指相同的制粒技术,本文使用的术语“水分活化干法造粒(MADG)”是1987年该技术的发明者创造的.
当MADG应用于制备速释制剂和控释制剂时显示了湿法制粒的优点,如增加粒度、提高颗粒流动性和可压性。这种技术的其他优点包括:应用范围广、效率高和能耗低,连续生产过程中操作工序少。然而,由于药物的稳定性和操作问题,水分活化干法制粒技术不能用于载药量高的药物、对水分敏感的药物及吸湿性药物。理想的水分活化干法制粒机应配备叶轮,叶片,切割刀,以保证物料良好的运动混合状态。因此,高速剪切混合制粒机加喷雾器将是一个适合MADG设备。
热粘合制粒(TAG)
台北卫明制药公司(台北,台湾)开发了热粘合制粒技术,类似于湿制粒技术,采用少量制粒溶液和热量使物料团聚。热粘合制粒法的原理示意图见图8。与单独使用水为制粒溶液的水分活化干法制粒不同,该工艺以水和溶剂为制粒溶液,制粒过程中对物料进行加热可促进制粒过程。
即在一个封闭的旋转系统中药物和赋形剂混合物加热到温度范围为30℃–130°C,以促进粉末颗粒的团聚。由于粉末颗粒团聚期间只加入少量的制粒溶液,所以无需干燥过程。经冷却、过筛后制得所需粒度的颗粒。
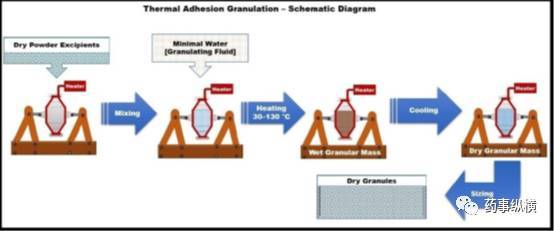
图8热粘合制粒法的原理示意图
热粘附制粒技术一项是非常简单方便的制粒方法。在封闭的空间中利用少量水分和粘合剂就能制备压缩性好的颗粒或改善辅料的特性.。因制备的颗粒圆整度高,流动性好,抗张强度高,可用于直接压片,且制得的片剂具有硬度适宜、脆碎度低的特点。热粘附制粒技术的缺点是需要消耗大量热量和热量调节设备。热粘附制粒技术并不适合所有的粘合剂,也不适合热不稳定的药物。
熔融制粒
熔融制粒或热熔制粒是一项用可熔性粉末作为粘合剂,在较低的温度下(50–90°C)熔化或软化后使粉末团聚的制粒技术。图9为熔融制粒的原理示意图。原辅料粉末与熔融或软化的粘合剂发生团聚经冷却凝固完成造粒过程。
低熔点粘合剂可以以固体颗粒的形式加入到制粒机中,粘合剂在制粒过程中融化(过程中融化或原位熔融制粒)或粘合剂以熔融液的形式,(以喷雾或泵液的方式)随机的分散在药物粉末中,因此,粘合剂的加入方式可以有多种选择。更具体地说就是,熔融制粒过程中的原位熔融过程是将药物、粘合剂和其它赋形剂混合物加热到粘合剂熔化范围内或其以上的温度。而喷洒熔融液过程是将熔融的粘合剂溶液随机喷洒在加热的原辅料粉末上。
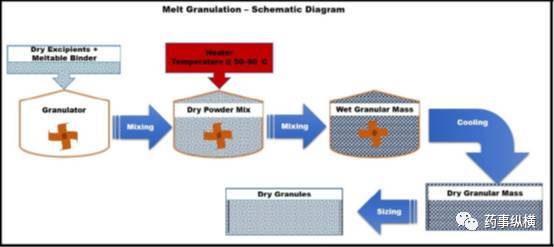
图9为熔融制粒的原理示意图
熔融制粒可替代其他湿法造粒方法应用于遇水敏感的药物。此外,与传统的湿法制粒工艺相比,本方法主要有以下几个优点。制粒过程不需要有机溶剂或水溶剂,因此,没有对有机溶剂的使用或回收的环境要求;因制粒过程中没有水分润湿和干燥阶段,而减少制粒时间和能源消耗。熔融制粒可用于水分敏感药物的制粒,进一步提高原料药的稳定性。熔融制粒的主要缺点是在操作过程中,需要高温加热,从而会导致不稳定的原料药降解或氧化,尤其是不耐热的药物。
制粒过程中使用的粘合剂可以是亲水性也可以是疏水性的。可溶粘合剂的亲水/疏水特性是影响药物溶出行为的关键因素。熔融制粒的设备有高速剪切混合制粒机和流化床制粒机。近年来,由于熔融制粒相比传统湿法制粒工艺技术具有上述众多优点,熔融制粒越来越引起大家的关注。
冷冻制粒
冷冻制粒技术,即喷雾冷冻后冷冻干燥,制粒过程中将溶液或混悬液喷洒到液氮中,冷冻的液滴通过冷冻干燥法冻干。将粉末混悬液喷入液氮中,立即冷冻成颗粒,在随后的冷冻干燥过程中,将冻结颗粒中的水分通过升华干燥的方式去除。该制粒方法的原理示意图如图10所示。以水或有机溶剂为溶剂的溶液经冷冻制粒技术,可制得流动性良好的球形颗粒。这项制粒技术的意义是,在溶液或混悬液中的原料药的结构和均匀性都被保留在颗粒中。虽然各种分散形式的原辅料均可以使用这种制粒技术的制粒,但是本方法更适合于将细粉与适当的添加剂混合后制粒,有助于提高混合均一性。
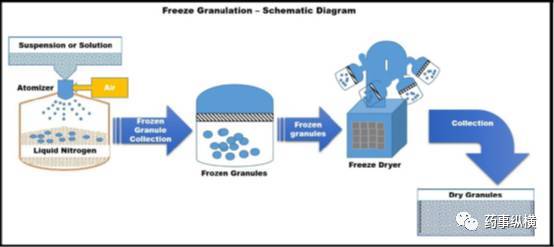
图10冷冻制粒方法的原理示意图
冷冻制粒技术在将混悬液制成颗粒时能很好地保持颗粒的粒径和均匀性。再分散的肠外制剂、纳米制剂,固体自乳化药物输送系统等,均可通过本技术制备,以保持颗粒的粒径和均一性。混悬液的均一性最终决定和反映了颗粒均一性。在医药工业中,低温冷冻干燥制粒在可减少有机物质的破坏,在提高药物的稳定性和溶解性方面更有优势。
据powderpro AB介绍,与喷雾干燥相比,冷冻制粒产生的蛋白质颗粒明显具有质轻、多孔的特点,由于良好的空气动力特性制得的粉体颗粒具有优越的气溶胶性能。
这个制粒过程的主要优点有:通过控制混悬液的浓度控制颗粒密度,制备无孔颗粒;由于制粒过程中无微小颗粒或粘合剂分子的迁移现象,颗粒均一性高;由于温和的干燥过程,可适用于热敏感的化合物制粒;由于损失率低,产品收率高;可回收过程中使用的有机溶剂。
虽然可以使用凝固点在-25~10°C范围内的有机溶剂,但在这种制粒方法中,水依然是首选溶剂,因此,对于溶解度差的药物和辅料的制粒过程应用本制粒时可能会受到限制。冷冻制粒技术是由瑞典陶瓷学会在1980年底开发的。目前,powderpro AB公司(2000年从瑞典的陶瓷研究所分离出来的子公司)在开发,生产,销售冷冻制粒设备。
泡沫制粒
泡沫制粒或泡沫粘合剂制粒技术,类似于喷雾团聚制粒,制粒过程中将液体/水粘合剂以泡沫而不是以喷雾或浇注的方式,加入到粉末颗粒中制粒。
图11显示了该技术的原理示意图。2003年,陶氏化学公司(米德兰,米河)首次将泡沫粘合剂用于高速剪切制粒和流化床制粒。将泡沫发生器安装在高剪切造粒机或流化床造粒机的粘合剂溶液罐中,粘合剂以泡沫而不是以喷雾或浇注的方式加入粉末颗粒中。这种加入方式可消除因粘合剂的分布不均匀而影响片剂的硬度和药物释放的现象。
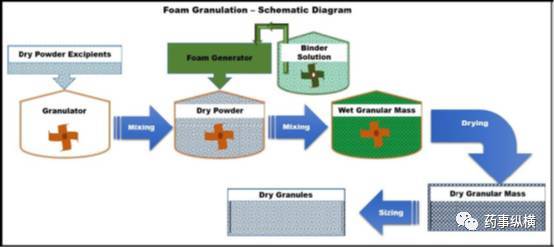
图11泡沫制粒技术的原理示意图
该技术正是利用泡沫粘合剂的表面积合体积均比喷雾粘合剂高这种特性,成功的提高了粘合剂在粉末颗粒上的分布范围,使得粘合剂用量低于常规的喷雾湿法制粒方法所需的粘合剂量。
此外,喷出的液滴具有较低的扩散-浸透比,这意味着往往因液滴渗入粉末,而不是在颗粒的表面扩散,而造成局部过湿,所以喷雾湿法制粒需要大量的粘合剂,随后还需要干燥步骤除去多余的水分。而泡沫粘合剂具有较高的扩散-浸透比,粘合剂仅涂布到颗粒表面,而不是浸入颗粒内部,从而导致制粒过程中粘合剂的用量减少,分布均匀。泡沫制粒提高了制粒的重现性,缩短了制粒时间。最重要的是,泡沫制粒技术消除了喷嘴及其相关的操作变量和堵塞问题。
除了上述优点外,由于本技术其能够使粘合剂均匀分布的特性,更有利于低剂量或高活性药物的混合。另外,还由于粘合剂的用量少,制粒时间短,除了速释制剂和控释制剂外,对水敏感的药物也可以使用该制粒技术。泡沫制粒的设备就是标准的湿法制粒设备,如高/低剪切混合制粒机,流化床造粒机等,加上泡沫发生器即可。虽然这项技术有许多优点,但仍需对泡沫质量,工艺参数,设备种类,泡沫流动模式,混合行为等进行进一步了解探讨。此外,监管审批将是一个需要克服的巨大障碍。
结束语
技术和工艺的创新,可改善和简化现有的制粒过程,除了影响产品的开发过程、时限及经济效益外,还有助于提高产品的工艺和质量。在过去几年里药物制粒技术和工艺已显著提高。高效的制粒方法,一直吸引着医药行业的热切关注,推动着全球制药企业的科学家研究和发展新的制粒技术。在制剂开发过程中,制剂研究人员在工艺选择阶段必须考虑药物的特性。每种制粒技术都有自己的优点和局限性,因此,在选择制粒技术和工艺类型时,除了制粒技术和工艺本身外,也需要深入了解药物的理化性质,赋形剂种类,所需颗粒的流动性和释放特性等。本文只综述了普通制剂制粒技术的最近发展。对于新剂型——口腔崩解片(ODTS)
如:orasolv®,Durasolv®,wowtab®,Flashtab®,zydis®,flashdose®,OraQuick®,lyoc®,advatab®,Frosta®,Quick-Disc®和Nanomelt®等以上市的口崩片产品,以超出了本文的介绍范围。在制药行业,虽然有各种制粒技术不断涌现,但由于种种障碍如;生产效率,效益,监管等问题,只有少数制粒技术能成功用于工业生产。作者认为本文介绍的几种制粒技术在成功产业化之前应对其设备、工艺进行改进。这些技术仅是提供了一个技术创新的平台。
参考文献略
原文名称:Granulation techniques and technologies: recent progresses;作者:Srinivasan Shanmugam;出版杂志:BioImpacts
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多