灌装——生物制品制造的关键

生物制剂市场正在逐年增长,每年的增长率达10-15%,估计占所有药品销售额的20%。2014年,仅在美国就有41种生物制剂获准上市,这是自1990年代以来一年内批准的最高数量。近几年来随着生物制剂研发的持续升温,“大型制药公司”继续加大生物制剂研发和制造能力的投资,有900多种生物产品正在开发中,所有迹象都表明生物药物市场将持续增长。
生物制药是由细胞培养或其他生物体来源的培养物制造或提取的。这些产品通常是蛋白质、核酸、疫苗、细胞或病毒。一般来说,与传统的化学合成药物相比,生物药物的生物分子更大、更复杂,其质量属性取决于生物制造工艺。生物治疗制剂复杂性的一个常用类比是将它们的相对大小与其他药物进行比较。下表1显示了从生产小分子(如阿司匹林)到单克隆抗体(如曲妥珠单抗)(基因泰克/罗氏的赫赛汀)的差异,从比较中可以看出小分子化药和生物药物就像是制造自行车到制造喷气式飞机的差异。
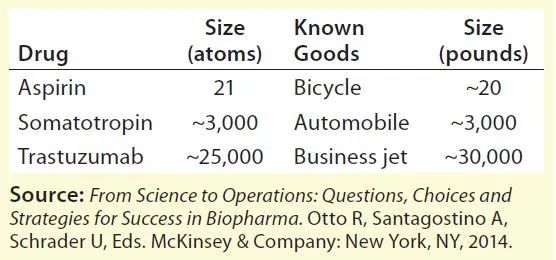
表1:药物不同制造工艺的比较
生物制剂不仅更难生产,供应链更复杂,而且它们的开发和制造成本也明显更高。由于需要证明和检测的药物分子的大小以及蛋白质与其环境之间复杂的物理化学相互作用,必须以不同于小分子药物的方式处理。
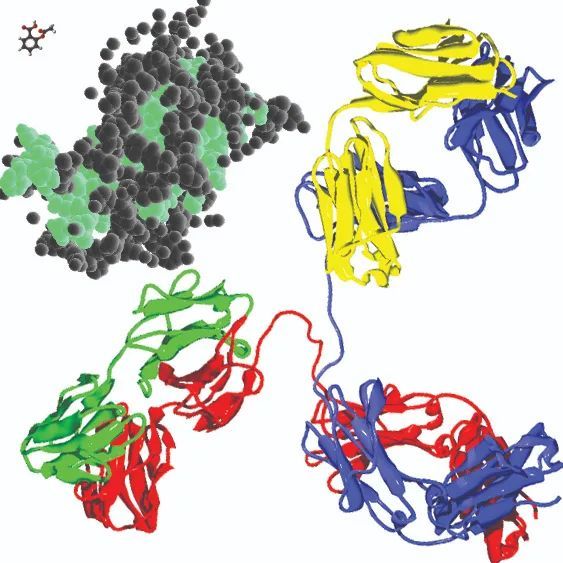
阿司匹林(左上角)、生长激素(黑绿色)和抗体(最大)——近似比例的分子模型图。
蛋白质结构和稳定性
蛋白质治疗制剂是高分子量(High Molecular Weight,HMW)多肽,其生物活性需要特定的三维结构。它们的结构比小分子复杂得多,由四种不同的结构层次组成:一级、二级、三级和四级。
一级结构描述了构成蛋白质的氨基酸的线性序列。人类蛋白质由20个标准氨基酸残基组成,所有氨基酸残基都因特定的分子侧链而异。蛋白质的独特序列定义了其结构和功能。
二级结构是指蛋白质分子内由酰胺氢和羰基氧之间的氢键定义的规则局部子结构。最常见的二级结构是α螺旋和β折叠。
三级结构描述了整个蛋白质的整体三维结构。它的折叠主要由疏水相互作用驱动,但也由氢键、盐和二硫键稳定。
许多蛋白质由多条多肽链组成。四级结构是指这些蛋白质亚基如何相互作用并排列形成更大的复合体。蛋白质复合物的构象通过驱动其组分三级结构的相同相互作用得到稳定。
防止降解和变性是蛋白质治疗的制造和长期贮存过程中保持安全性和有效性所必须的。许多因素会对蛋白质稳定性产生负面影响。蛋白质的氨基酸骨架(一级结构)可以通过共价键的形成和破坏而改变。这种化学修饰可能由氧化、脱酰胺、肽键水解、二硫键交换和交联引起。
因为驱动和稳定高阶二级、三级和四级结构的相互作用本质上是弱相互作用,蛋白质容易受到物理和构象降解的影响。一些外部因素可能会导致物理退化:过高的温度、变化的酸碱度、机械搅拌、高剪切力和表面的疏水性分子、可浸出物/提取物、非极性溶剂的存在、和某些赋形剂。蛋白质也具有“粘性”,易于吸附(粘附于表面)和聚集(聚集在一起)因为它们在溶液中具有疏水性。蛋白的聚集受到特别关注,因为它们已被证明与改变生物活性和增加的免疫原性有关。
对于蛋白质聚集,可以通过许多机制:
暴露于液-气、液-固和液-液界面;
机械应力,例如搅拌和泵送;
反复冻融;
形成聚体的速率和数量的溶液条件;
与金属表面的相互作用;
某些配体的存在。
在高浓度下,蛋白质-蛋白质相互作用会显着增加BDS的粘度,这反过来会降低其可制造性并使药物递送变得复杂。由于某些氨基酸残基(色氨酸、酪氨酸、苯丙氨酸和半胱氨酸)易受光和氧化影响,因此暴露在光线下会引发化学和物理降解。在某些情况下,这些因素可以协同作用,从一个变化触发另一种机制的变化。例如,疏水表面会导致蛋白质错误折叠,从而导致聚集。
药物灌装填充操作的设计必须了解每种药物蛋白的独特特性和可能影响特定蛋白的性质和稳定性的外部因素。必须有特殊的工艺、程序和设备,以确保灌装制造过程中产品的完整性。
生物制剂灌装填充的特殊考虑
在填充和完成灌装的过程中,保留蛋白质的三维(3D)结构至关重要。由于许多条件会对治疗性蛋白质的结构、功能和稳定性产生负面影响,因此在生物制造过程的每一步都必须特别小心。下图1说明了生物药品制造中的众多步骤和操作。
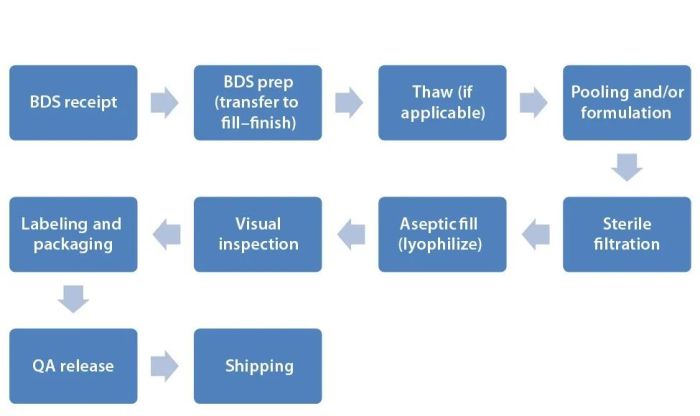
图1:生物药品(灌装)制造示意图。
对于生物制剂的制造,必须制定特殊处理程序以接收BDS。质量控制(QC)人员根据GMP规范确定了正确的BDS处理方法和目视法物理检查方面的培训。检测项目通常包括容器完整性、储存条件(例如,液体或冷冻)、容器数量等。一旦被QC小组接受,BDS就会被转移到适当的存储地点,直到其预定的灌装日期。管理不合格BDS的程序也应该到位,作为制造企业质量体系监督的一部分。
端到端的冷链设施和可追溯性对于保持生物BDS和药品的质量至关重要。在2-8℃、-20℃和-80℃下经过验证的储存条件足以支持大多数蛋白质类的生物制剂。冷链程序应包括24小时温度监控、发生故障时应遵循的程序以及用于制冷和应急电源的辅助系统。药品制造企业需要定期的进行预防性维护计划,以确保其设备正常工作。延长保存时间或多天灌装过程的中间的存储,还包括需要适当的转移和存储的程序,以保持BDS的无菌和最佳温度。
冷冻BDS为生物制剂制造带来了许多优势:将BDS与药品灌装制造过程脱钩,降低微生物污染的风险,并提高BDS稳定性以实现灵活的灌装时间表。然而,根据产品开发过程中获得的数据,应制定详细的解冻程序,以确保解冻冷冻的BDS不会损害蛋白质活性和稳定性。一旦BDS解冻,相关的稀释、合并和配制方案必须温和,以防止蛋白质溶液起泡或飞溅。引入高剪切力可以诱导蛋白质聚集或引起影响蛋白活性或溶解度的构象变化。因此,需要低剪切力的混合方法。理想情况下,冷冻和解冻步骤都需要在封闭系统中进行,以防止BDS暴露于外部空气,从而降低微生物污染的可能性。
确定用于无菌过滤的过滤器的准确尺寸对于减少高价值生物BDS的滞留和损失很重要。在无菌过滤和容器密闭灌装单元操作中,蠕动泵已成为大多数生物制剂灌装过程的标准。使用蠕动泵调整流速以防止起泡和飞溅比使用活塞泵更简单。使用此类泵,清洁和更换也变得更加高效,因为在这个过程中使用了一次性管道、连接器和填充针是唯一直接接触产品的材料。如上所述,大多数生物制剂对剪切力很敏感。蠕动泵为更温和的药品生产提供低压泵送。
对于基于生物制剂的注射液填充后的成品,手动目视物理检查是美国和欧洲的标准。这种QC方法在很大程度上依赖于操作员的经验、培训和技能。监管机构希望有一个特征明确且稳健的检查过程。需要广泛的培训以及健全的资格制度,以确保操作员具备必要的技能,以检测一长串完整的潜在药品和容器缺陷。
生物制剂灌装填充制造企业面临的一些挑战包括:
处理敏感的生物产品;
检查透明和不透明的悬浮液;
检查琥珀色(茶色)小瓶;
区分异物和产品相关的颗粒物。
标签、包装和运输过程都必须遵守GMP规定。需要正确处理以消除可能对稳定性产生不利影响的不必要的搅拌。在药品的整个制备和运输过程中,必须保持“冷链”。也就是说,产品不得受到温度波动的影响。在运输过程中也很重要的是安全包装,并提供适当的温度波动和机械搅拌保护。
适当时还应包括温度监测器、数据记录器和全球定位系统(GPS)跟踪器。经验证的集装箱,例如来自CSafe Global的集装箱,已被证明可以在不影响产品质量的情况下运输价值较高的生物制剂。
其他关键方面
高度浓缩的蛋白质溶液可能具有粘度水平,这给药品灌装操作带来了特殊挑战。通过小直径管道泵送粘性溶液会产生剪切和其他可能降解蛋白质的效应。使用不同肖氏硬度(参见下文中“定义”中内容)、直径和配置的管道通常有助于制造商处理粘性产品解决方案。在较高温度下执行关键单元操作可以降低粘度,但制造企业必须在选择该选项之前确定此类条件对给定蛋白质的稳定性和活性的影响。
大多数蛋白质生物治疗制剂是通过微生物发酵或哺乳动物细胞培养制成的。用于此类生产过程的原材料、培养基和生长条件可以促进表达系统的生长。微生物污染会影响生物制造过程的稳健性和可重复性,以及最终药物产品的纯度、效力和安全性。必须采取适当的控制措施来防止生物设施和设备中的微生物生长。包括一系列的清洁计划,其中包含消毒剂/清洁剂的轮换,以及确保培养接种前生长环境无菌的控制措施。必须在整个药品生产过程中保持低生物负载—从BDS接收到无菌灌装。
由于生物制剂开发企业越来越关注个性化医疗和孤儿药,该行业已经看到推向市场的小批量产品数量的显着增加。即使原料药是“内部(自己生产)”生产的,许多公司也会将药品生产活动外包。因此,大多数灌装填充操作是在多产品设施(共线)中执行的。大多数此类设施已转换为一次性,原因是一次性系统提供了许多好处:降低污染风险、提高操作灵活性和缩短转换时间。获得的效率可以促进和加快生物制剂从临床试验到商业上市的进程,从而增加公司的投资回报。
维持蛋白质的稳定性必须考虑到许多受内在和外在因素控制的复杂物理化学现象。由于生物制剂灌装填充需要大量的操作,此类操作具有破坏治疗性蛋白质生物活性状态的潜在风险。药品的配制、过滤和灌装是生物制剂开发中经常被忽视但至关重要的部分,需要特殊能力来确保产品在整个制造、运输和长期储存过程中的高质量。
2015年,Lonza扩大了其现有的生物药物产品制造业务,以生产抗体药物偶联物(ADC)等产品。包括ADC和高效活性药物成分(HPAPI)在内的肿瘤疗法代表了制药行业快速增长的细分市场之一。这些产品需要专门的制造设施和基础设施,以确保其安全处理、制造和交付。Lonza的新设施将包括专门用于生物偶联、配方、纯化、质量控制和无菌灌装完成的领域,包括冻干。工厂为了在安全处理和操作极低的接触限值(OEL)化合物,同时保持无菌条件和GMP合规性。
普遍外包整个生物制剂市场以10-15% 的速度增长。经过分析测试,药品填充和完成是生物制剂中外包最多的活动,预计在可预见的未来会增长。这将转化为外包填充-完成市场的稳定增长。拥有必要的生物制剂专业知识、监管记录和能力的合同制造组织(CMO)有机会在这个高增长领域获得业务。自2015年以来,Lonza一直是药瓶和注射器无菌药品灌装领域的领先专家。该公司的经验、专业知识和监管记录在过去几年中带来了巨大的收入增长。我们预计这种增长将在未来几年继续下去。
名词解释:
冷链:温度受控的供应链,在不间断的情况下,提供一系列不间断的储存和配送温度以保持给定的温度范围。
交联:将一个聚合物链连接到另一个聚合物链的键(共价键或离子键)。
脱酰胺:一种化学反应,其中从有机化合物中去除酰胺官能团(在蛋白质中,破坏天冬酰胺和谷氨酰胺氨基酸的含酰胺侧链)。
赋形剂:包含在制剂中作为稳定剂、基质、填充剂或增强剂的非药物物质。
可萃取物:在过高的温度和时间条件下暴露于某些溶剂时从塑料材料迁移的化学物质。
接种:将微生物或细胞引入培养基中。
可浸出物:在正常条件下从塑料中迁移出来的化学物质。
配体:与其他(通常较大)分子结合的分子。
氧化:分子、原子或离子因与氧相互作用而失去电子。
肽键水解:通过引入水来破坏肽键。
蠕动泵:一种容积式泵,在软管内装有流体,软管安装在泵壳内。
活塞泵:一种带有高压密封的正排量泵,与活塞往复运动
剪切力:当层相对于彼此横向移动时,由压力产生的物质结构中的应变。
肖氏硬度标度:由Albert Ferdinand Shore在1920年代定义,一种测量聚合物、弹性体和橡胶硬度的标度,从D(硬)到A(中)和OO(软)。
参考:
1 Thomas A. Global Biological Drugs Market Will Reach US$287 Billion in 2020. Persistence Market Research: New York, NY, 22 June 2015; www.persistencemarketresearch.com/mediarelease/global-biological-drugs-market.asp.
2 Biologic Therapeutic Drugs: Technologies and Global Markets. BCC Research LLC: Wellesley, MA, January 2015; www.bccresearch.com/market-research/biotechnology/biologic-therapeutic-drugs-technologies-markets-report-bio079c.html.
3 Carroll JD. Biopharma Posts a ChartTopping 41 New Drug Approvals in 2014. Fierce Biotech 2 January 2015; www.fiercebiotech.com/special-reports/biopharma-posts-chart-topping-41-new-drug-approvals-2014/2015-01-02.
4 Van Arnum P. Big Pharma’s Investment in Biologics. PharmTech.com 3 May 2013; www.pharmtech.com/big-pharmas-investment-biologics.
5 Medicines in Development: Biologics. Pharmaceutical Research and Manufacturers Association: Washington, DC, 2013; www.phrma.org/sites/default/files/pdf/biologics2013.pdf.
6 Technical Brief Volume 8. Protein Structure. Particle Sciences Drug Development Services: Bethlehem, PA, 2009; www.particlesciences.com/news/technical-briefs/2009/protein-structure.html.
7 Watts A. Biological Drugs: Practical Considerations for Handling and Storage. University of Bath Department of Pharmacy and Pharmacology: Bath, UK, 22 May 2013; www.slideshare.net/bathasu/biological-drugs-practical-considerations-for-handling-and-storage.
8 Patel J, et al. Stability Considerations for Biopharmaceuticals, Part 1: Overview of Protein and Peptide Degradation Pathways. BioProcess Int. 9(1) 2011: 20–31; www.bioprocessintl.com/manufacturing/formulation/stability-considerations-for-biopharmaceuticals-part-1-332821.
9 Kerwin BA, Remmele RL. Protect from Light: Photodegradation and Protein Biologics. J. Pharmaceut. Sci. 96(6) 2007:1468–1479; doi:10.1002/jps.20815.
10 Kashi R. Challenges in the Development of Stable Protein Formulations for Lung Delivery. AAPS Symposium (Baltimore, MD, 9 September 2011); http://docplayer.net/11725148-Challenges-in-the-development-of-stable-protein-formulations-for-lung-delivery.html.
11 Maa YF, Hsu CC. Effect of High Shear on Proteins. Biotechnol. Bioeng. 51(4) 1996: 458–465; www.ncbi.nlm.nih.gov/pubmed/18629798.
12 Child J. Minireview: Protein Interactions (honors thesis). University of New Hampshire Scholars’ Repository: Durham, NH, Fall 2012; http://scholars.unh.edu/cgi/viewcontent.cgi?article=1081&context=honors.
13 Puri M, et al. Evaluating Freeze–Thaw Processes in Biopharmaceutical Development: Small-Scale Study Designs. BioProcess Int. 13(1) 2015: 34–45; www.bioprocessintl.com/manufacturing/fill-finish/evaluating-freeze-thaw-processes-biopharmaceutical-development-small-scale-study-designs.
14 Butschli J. Assessing Trends in Temperature-Sensitive Biologic Shipments. Life Sciences Logistics 31 August 2015; www.lifescienceslogistics.com/logistics/temp-control-packaging/assessing-trends-temperature-sensitive-biologic-shipments.
15 Burgess B. Packaging Trends for Biologics. Healthcare Packaging 9 April 2013; www.healthcarepackaging.com/applications/healthcare/packaging-trends-biologics.
16 Lolas A. Microbial Control Strategies in Bioprocessing Falling Short of Assuring Product Quality and Satisfying Regulatory Expectations. Am. Pharmaceut. Rev. 2 April 2013; www.americanpharmaceuticalreview.com/Featured-Articles/134040-Microbial-Control-Strategies-in-Bioprocessing-Falling-Short-of-Assuring-Product-Quality-and-Satisfying-Regulatory-Expectations.
17 Lambert P. Dispensing Biopharmaceuticals with Piston and Peristaltic Pumps. PharmTech.com 17 September 2008; www.pharmtech.com/dispensing-biopharmaceuticals-piston-and-peristaltic-pumps.
本文来源于药时空
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多