API固有溶出怎么测,看USP怎么说
API在很多时候是影响制剂溶出的一个关键因素。FDA推荐的《QBD for ANDAs: An Examplefor Immediate Release Dosage Forms》中,采用人体生物等效性实验评价了API粒径对溶出、吸收的影响。此种方式难能可贵,但时间、金钱代价高昂。有没有一种方法直接测定API的溶出,以判断其是否为影响制剂溶出的关键因素?USP给出的方法是将API压成薄片,连模具一起放入溶出杯,转动,取样,检测,绘制曲线。
本文(USP39-1087固有溶出——旋转浆碟法和固定浆碟法测试程序)讨论了在给定溶剂介质中,固定暴露表面积药片的溶出速率。本文中药片指在测试中使用适当的压力压缩API得到的非崩解片。采用具有指定物理尺寸的单一表面积用于实验。测定溶出速率可能是重要的,因为它可以预测潜在的生物利用度问题,也可用于表征制剂,如赋形剂或API。固有溶出用于研究用,未在个论中提及。
溶出速率通常表示为单位时间在溶出介质中出现的溶质的量(如,质量·秒-1),但溶出通量表示为每单位面积的速率(例如质量·cm-2·秒-1)。溶出通量,对于API,通常称为固有溶出速率。溶出速率受固态性质如结晶状态(包括多晶型物和溶剂合物)以及非结晶度的影响。许多方法可改变化学分子的物理化学性质,增加溶解度和溶出特性,包括使用共沉淀物和无定形固体分散体。杂质也可以显着影响溶解特性。溶解特性还受外部因素的影响,如表面积,流体动力学和溶解介质性质(包括溶剂,表面活性剂,温度,流体粘度,pH,缓冲液类型和强度)。
旋转浆碟法和固定浆碟法测试程序是通用的,可以在各种测试条件下研究化合物的药学方面的特性。两种装置共有的特征包括:
(1)适用于标准溶解测试工作站,并且使用模具保持药片。
(2)将API压成片,在试验过程中不剥离、不脱落。
(3)表面积固定,已知几何形状和物理尺寸。
(4)模具在容器中的位置固定,降低流体动力学条件的变化。
两种方法的区别是溶解介质流动的动力。旋转浆碟法是模具旋转,流体静止;固定浆碟法是通过桨或其它搅拌装置使介质流动。
1、试验程序
旋转浆碟法和固定浆碟法测试程序为:利用适宜的装置压片;将片和模具放入合适的介质中;调整合适的位置;测定。
压片装置通常由模具、上冲头和下面板组成,下面板由钢或其它材料制成,能压成非崩解片,也可以是模具和两个冲头组成。压成的药片直径0.2-1.5 cm。
2、压片
将光滑的下表面板连接到模具的下方,或者使用适当的夹紧系统插入下冲头。精确称取一定量的API,放入模腔。将上冲头放入模腔,在液压机上以所需的压力压制粉末,得到非崩解片。15MPa,压1分钟,通常对于许多有机结晶化合物是足够的。但是应当优化压缩条件,避免形成毛细管。对于一个化合物,一旦优化,压片参数需固定,以便于比较不同的样品。
压片时,晶型可能会改变。应该通过XRD或其它技术来进行确认。拆下表面板或下冲头。在表面上吹压缩空气或氮气,除去药片表面的松散粉末。
3、溶出介质
溶出介质是重要的考虑因素。只要有可能,应满足漏槽条件,以避免因溶液接近饱和而降低溶出速率。通常在水的介质中进行。为了接近体内条件,可以在37℃的生理pH范围内测量。在可能的情况下,采用测定固有溶解度的相同条件。水应在脱气后立即使用,避免在片或模具表面形成气泡。
介质温度和pH需控制,特别是对可电离的化合物和盐。对于后者,溶出速率可能强烈依赖于pH,缓冲液物质和浓度。实验中的一个简化假设是片子表面处的pH与本体溶出介质相同。对于不可电离的化合物,这是相对简单的,因为溶出速率无显着依赖于pH。对于酸和碱,片子表面处和附近的pH可能改变。在这些条件下,由于溶质的自身缓冲能力,片子表面的pH可能与本体溶出介质不同。为了评估固有溶出,应选择合适条件以消除溶质缓冲、溶液pH的改变和在片子表面沉淀其它固体的影响。对于弱酸,溶出介质的pH应为1-2 pH单位低于API的pKa。对于弱碱,介质的pH应比API的pKa高1-2个pH单位。
4、装置
旋转浆碟法——包括冲头、一套有螺丝钉的钢制模具。模具的底部具有三个螺孔,用于固定表面抛光的圆盘。模具的空腔用来装入一定量的API,插入冲头,压片。实验装置如图1。
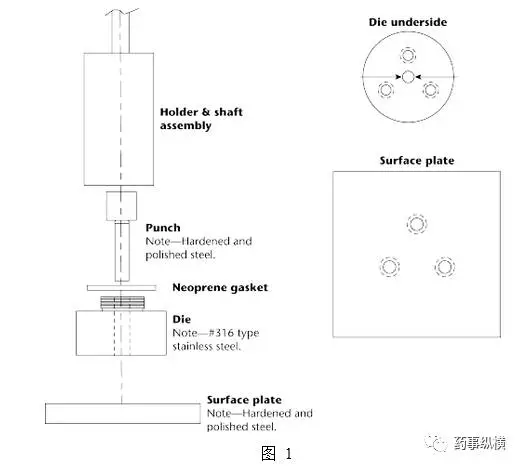
将模具组件连接到轴上。定位,使模具组件浸入到溶解介质中(图2),药片的一个表面暴露在空腔的下面,暴露的表面距离容器底部不小于1.0cm,并且水平。模具组件旋转时摆动最小,不允许在片子或模具表面上形成气泡。
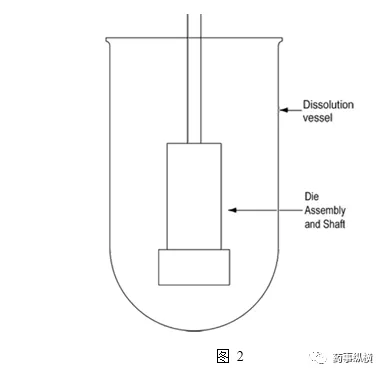
实验参数(仅供参考):
1) API量<500 mg;
2) 压力:1000/2000 psi,1-2 min;
3) 转速:60-500 rpm(优选300rpm);
4) 距溶出杯底部的距离:不低于1.0 cm;
5) 介质体积:225-900 ml;
6) 模具直径:0.1-1.0 cm。
固定浆碟法——装置见图3和图4.
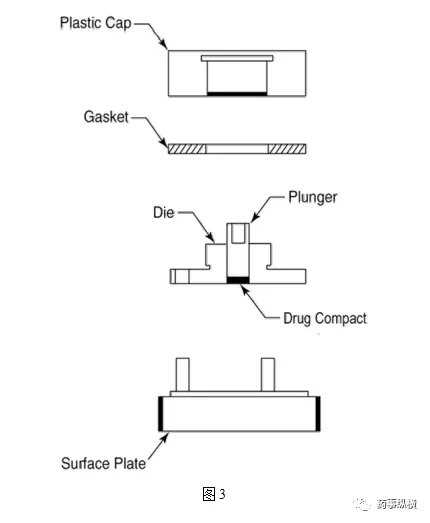
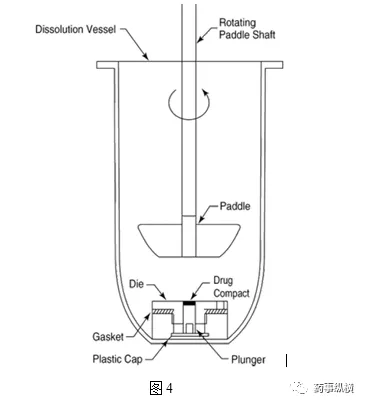
溶出速率取决于旋转速度和精确的流体动力学。采样间隔由溶出速度决定(参见旋转桨碟)。计算各时间点的累积溶出度。
5、数据分析与解释
计算累积溶出度,绘制溶出曲线。对溶出曲线的初始线性区域中的数据点进行线性回归分析。该斜率即溶出速率(质量·秒-1)。
累积溶出度与时间的曲线可能有曲率。当发生这种情况时,仅使用轮廓的初始线性部分来确定溶出速率。浓度对时间数据的向上曲率(正二阶导数)通常表示系统的实验问题,可能药片有破裂、脱层或崩解。溶出曲线的向下(负二次导数)曲率通常指示药片晶型转变或表面处的介质饱和。通常热力学较不稳定的晶型转化为更稳定形式,包括从无定形转化为结晶或从无水转化为水合物,或转化为相应的游离酸或游离碱或盐。如果出现这种曲率,可以通过XRD或类似技术检查是否存在转晶。
恒定表面积溶出速率以质量·sec -1为单位,溶解通量以质量·cm-2·sec-1为单位。通过将溶出速率除以药片的表面积来计算溶解通量。测试条件,包括装置、旋转速度、温度、缓冲液、pH和离子强度也应该记录下来。

固有溶出率压片机
目前固有溶出率的研究主要用于药物不同晶型、难溶性药物、生物药剂学分类等方面。固有溶出率在药物分类方面可以提供一种方便简单的方法,且压片时的压力,溶出介质的体积,模具的位置对溶出率的测定没有显著的影响。因此是一种相对稳定的溶出度研究方法。
文章来源:药事纵横
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多