美国药典新通则<477>使用者确定的报告阈值(USER-DETERMINED REPORTING THRESHOLDS)-解读
近期,美国药典委员会(USP)于《美国药典-国家处方集》在线版(USP-NF Online)中发布了已获批准的通则<477>使用者确定的报告阈值(USER-DETERMINED REPORTING THRESHOLDS) 。通则提供了详细内容,以支持用户根据其特定产品的药典检测方法的实施情况,为报告阈值赋予适当的数值。该通则以发表在"药典论坛”(Pharmacopeial Forum) 48(5)上的提议草案为基础,预计将于2024年5月1日在USP-NF 2024 Issue 1中正式生效。
关于USP-NF某些各论中删除报告阈值的规定数值的提议是基于美国食品药品监督管理局(FDA)的建议,随后USP通过"药典通告"发布了"USP-NF 各论中的报告阈值拟议政策变更"的通知,该药典通告于2019年8月13日首次发布,随后于2019年11月7日更新。利益相关方就拟议政策变更提出的评议和建议促成了两次圆桌会议,USP在会上进一步征求评论方的意见,这些意见以及其他利益相关方团体和USP专家志愿者的反馈信息,为新通则中反映的使用者确定的报告阈值的改进方法提供了依据。灵活的使用者确定报告阈值方法提高了某些USP-NF 各论与适用的ICH指导原则之间的一致性。
-
本通则适用于化学来源的原料药和药品制剂各论,即分别属于国际人用药品技术要求协调理事会(ICH)“Q3A(R2)新原料药中的杂质”和“Q3B(R2)新药制剂中的杂质”指南范围内的各论,不适用于兽医专用产品、生物/生物技术产品、肽、寡核苷酸、放射性药物、发酵产品和由此衍生的半合成产品、草药产品和粗品动物或植物来源的产品。
-
本通则引入了一种色谱分析方法中使用“用户确定报告阈值适当数值”的方法,在美国药典各论中引用本通则“使用者确定的报告阈值适当数值”时使用。在使用美国药典色谱检验方法时“使用者确定的报告阈值适当数值“提供了灵活的,符合特定产品预期目的报告阈值。在美国药典各论中”用户确定的报告阈值“通常会提供注释,以帮助非该产品持有者用于识别特定产品的报告阈值的适当数值,此补充信息不适用于法规符合性判定。对于监管机构批准的产品制造商” 报告阈值的适当数值 “在批准的产品申报文件中有规定,对于各论的其他用户,本注释提供的信息可以支持确定” 报告阈值的适当数值“。
支持确定“报告阈值的适当数值”的相关产品因素包括:活性原料药或制剂产品最大日剂量(即药物的最大每天给药量)和相关药品的给药途径。对于大多数药品最大日剂量(MDD)是确定“报告阈值的适当数值”的重要因素。在以下情况下,监管机构已经确定由于相关器官系统的高敏感性,通过特定给药途径暴露在杂质中会带来更高的风险,这时给药途径需要重点考虑,这些高风险类别的制剂类型包括但不限于眼科产品、鼻腔喷雾剂、吸入溶液、吸入悬浮液和吸入喷雾剂,对于这些制剂类型监管机构可能要求更保守的杂质识别阈值(对应于非特定杂质的质量标准),对于非特定杂质较低的可接受标准将需要相应较低的报告阈值。使用者应了解药品监管机构发布的与特殊给药途径有关的指导意见,以避免选择报告阈值的数值不合适(过高)。
关于最大日剂量MDD的信息可以在药品说明书中找到,在大多数情况下,说明书中的最大日剂量MDD是明确的和权威的,但是对于某些制剂最大日剂量MDD信息不够明确时,需要专家知识来计算最大日剂量,各论用户可以选择报告阈值的保守数值(即与较高最大日剂量MDD计算的值)。
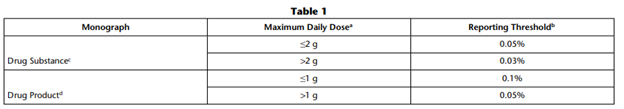
不同最大日剂量相对应的报告阈值的数值如下所示,国际人类用药技术要求协调理事会(ICH)指南:Q3A(R2)“新药中的杂质”和Q3B(R2)“新药品中的杂质”,转载于表1
C信息来源于 ICH Q3A(R2)新原料药中的杂质。
d信息来源于ICH Q3B(R2)新药制剂中的杂质。
报告阈值的数值不应超过非特定杂质的可接受标准(质量标准),例如原料药各论中规定的非特定杂质的可接受标准(质量标准)和药物制剂各论中指明的非特定降解产物的可接受标准(质量标准)。为确保杂质的充分报告,报告阈值的数值需小于任何非特定杂质或任何非特定的降解产物(如适用)的可接受标准(质量标准);对于已知异常强效、产生毒性和超预期药理作用的杂质,为解决潜在安全问题,较低的报告阈值可能更适用,基于对上述相关产品因素的总体评估,确定“报告阈值的适当数值”。
确保药典色谱检验方法的适用性是各论用户的职责,如通则<1226>“分析方法确认”所述,用户需确认药典分析方法在实际使用情况下的适用性,如果药典分析方法的确认不成功,则可以开发和验证替代的分析方法,参照美国药典凡例<6.30> “替代和协同办法和程序”。
在分析方法系统适用性要求中,需确认色谱系统在使用时具有足够的灵敏度, 在采用“用户确定的报告阈值的适当数值”的各论中,灵敏度溶液的浓度通常应与“确定的报告阈值的适当数值”一致,当用户选择较低的“报告阈值适当数值”时,可以选择降低灵敏度溶液的浓度或建立另一个适当的系统灵敏度检查(需有适当的验证数据支持)。
正如通则<1086>中所阐述的,当杂质检测规定了总杂质的限度或有特定杂质的定量测定时,选择适当的阈值设置和适当的积分条件是非常重要的,参加色谱法<621> “色谱法”、 <1225> “分析方法验证”和<1226> “分析方法确认”中信噪比、定量限和定量检测方法,分析方法的定量限应不超过(≤)报告阈值。

撰稿人 | 于英梅 药事纵横
责任编辑 | 胡静
审核人 | 何发















评论
加载更多