非最终灭菌无菌制剂潜在污染的风险分析 下篇
4. 生产工艺
4.1 除菌过滤
在考虑除菌过滤系统工艺时,应注意除菌过滤工艺的局限性。除菌过滤器不能将病毒或支原体全部滤除,因此在生产工艺中要考虑弥补除菌过滤的这些不足。
为了降低过滤除菌的风险,需要安装第二只已灭菌的除菌过滤器。在除菌过滤器完成工艺过滤以后,这两只过滤器中至少有一个要通过完整性检查。除菌过滤应在规定的工艺控制参数范围内进行,同时为保证除菌过滤的有效性,还应对影响除菌过滤效果的关键参数进行控制和记录。控制项目应包括除菌过滤温度、时间、压力、上下游压差等。最终的除菌过滤器应当尽可能接近灌装点,即尽可能地省略除菌过滤后料液的中间储存环节。
使用前,除菌过滤器必须经过灭菌处理(如在线或离线蒸汽灭菌、辐射灭菌等)。在线蒸汽灭菌的设计及操作过程应重点考虑滤芯可耐受的最高压差及温度。使用灭菌器进行灭菌时,通常采用脉动真空灭菌方法。灭菌过程应保证滤器能被蒸汽穿透,从而达成对过滤器的彻底灭菌。除菌过滤系统应尽可能地考虑采用在线灭菌,如果仍需采用离线灭菌后再装配的话,建议使用无菌连接器来降低无菌风险。
此外,尚在产品研发阶段,就需要对除菌滤芯进行细菌截留试验、化学兼容性试验、可提取物或浸出物试验、安全性评估和吸附评估等研究。对过滤过程中潜在可能引入的杂质和风险进行充分的评估。
4.2 模拟灌装
培养基模拟灌装是非最终灭菌无菌制剂的关键验证点,不符合规范要求的无菌工艺过程,不能通过模拟试验来证实其无菌控制措施的合理性。
对于冻干制剂,需要在液体灌装的基础上增加冷冻干燥工艺。培养基模拟灌装试验应从第一步无菌操作开始,直至无菌产品完全密封结束。
在进行基于无菌风险的模拟试验方案设计时,应注意设计要结合无菌生产工艺,尽量与实际无菌操作过程保持一致,以求试验结果真实反映生产过程的无菌保证水平。
在无菌生产工艺中,暴露操作对最终产品的无菌特性有着重要影响。如设备(或管道)的无菌连接、无菌容器的转运和更换、灌装等关键操作等,都是引入微生物污染的重点环节及风险点。因此,模拟试验方案设计应对这些过程中无菌防护措施的有效性进行仔细考察。
为了确认无菌生产工艺中无菌质量风险控制的有效性,通常采用生产过程中可能发生的最差条件进行模拟试验。值得注意的是,最差条件并不是指人为创造的超出允许范围的生产状况和环境。最差条件应基于风险等级并结合无菌生产工艺、设备装备水平、人员数量和干预等因素来设计。
4.3 清洁验证
在考虑清洁验证前, 应先确保厂房、生产设施和设备满足2010 版药品生产质量管理规范(GMP)中的基本要求:
• 生产特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其他用活性微生物制备而成的药品),必须采用专用和独立的厂房、生产设施和设备。
• 青霉素类药品产尘量大的操作区域应当保持相对负压,排至室外的废气应当经过净化处理并符合要求,排放口应当远离其他空气净化系统的进风口。
• 生产β- 内酰胺结构类药品、性激素类避孕药品必须使用专用设施(如独立的空气净化系统)和设备,并与其他药品生产区严格分开。
• 生产某些激素类、细胞毒性类、高活性化学药品应当使用专用设施(如独立的空气净化系统)和设备;特殊情况下,如采取特别防护措施并经过必要的验证,上述药品制剂则可通过阶段性生产方式共用同一生产设施和设备。
• 上述这几项的空气净化系统,其排风应当经过净化处理(并且排风口应不能位于其他空调取风口的上游)。
• 药品生产厂房不得用于生产对药品质量有不利影响的非药用产品。
适当的清洗程序对防止污染和交叉污染具有重要作用,清洁程序是需要预先经过验证的。至少连续三次应用清洗程序,并都获得成功,才能证明该方法的有效性。
清洁验证的目的是证明设备对产品、洗涤剂和微生物残留物的清洗一致并达到可接受的水平,以防止可能的污染和交叉污染。清洁验证被认为在多产品设施中尤为重要,并应在设备、消毒程序和服装洗涤等方面都进行验证。
对于难以清洁的产品、难以清洁的设备或安全风险高的产品,如果使用经过验证的清洁程序无法达到所需清洁验证的接受水平,则应考虑使用专用的设备。
4.4 工艺控制参数
一些工艺设备在验证的时候需要考虑最差情况,如隧道烘箱在做FH值验证时有3 种装载形式:(1)履带前面尚没有瓶,即开始生产的前期;(2)履带式前后都有瓶,即生产的中间时段;(3)履带后面已没有瓶,即生产将结束时。在验证中可以发现这3 种装载形式的FH 值是不一样的,一般来说第二种装载形式的FH 值最高。第一和第三种装载的FH 值哪个更高不能确定,这与隧道烘箱内原设计的风平衡策略有关。隧道烘箱的关键控制参数应该按照最低的FH 值来设定,以满足FH 值最低时也能够达到除热源的目的。
5. 生产环境
5.1 高效过滤器无菌空气是直接与物料相接触的,特别是在除菌过滤工艺以后,如果不能够确保无菌空气的质量,将给产品带来巨大的风险。高效过滤器必须确保其完整性符合要求,从而保障环境空气的无菌效果。相关法规中规定高效过滤器的局部泄漏率要小于0.01%,并且对无菌制剂的生产设施来说应每半年就检测一次。当然,这一检漏行为严格意义上讲只能称为完整性检测,因为这仅是用户在使用状态而非标准状态下进行的检测。
由于采用的标准不同以及对标准理解不透彻,在检漏过程中可能会存在着一定的风险。首先检漏所选择的仪器不能是激光粒子计数仪,虽然激光粒子计数仪的灵敏度较高,但它仅能对一个粒径的粒子进行计量。所以它在高效过滤器下游计量到的粒子是不全面的,这样检测到的泄漏率自然就偏小了。只有在用单分散粒径的气溶胶(如聚苯乙烯乳胶PSL)发尘时,其检测结果才与真实数据接近。需要用光度计来进行高效过滤器下游粒子的计量,它是能够计量所有透过粒径粒子的。
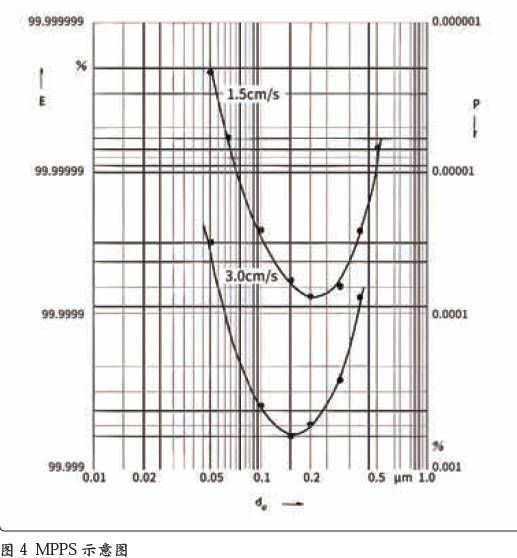
在保证高效过滤器上游的粒子浓度时,所用气溶胶的粒径也有很大的影响,图4 是最易通过粒径(MPPS)过滤效率的示意图。举例来说, 在采用PAO 检测时有冷发生和热发生两种发生器可供选择。冷发生的粒径大致为0.5 μm,热发生的粒径大致为0.3 μm,从图4 上可以看到,随着粒径增大,过滤效率发生的变化很大。目前只有EN 1822 标准才定义用MPPS 来进行检漏,也只有用EN 1822 标准进行检测,检测效率达到99.995% 的高效过滤器才能称为H14 级别。在EN1822 中有这样一段话:对于H13级别过滤器(整体MPPS 效率大于99.95%,局部MPPS 效率大于99.75%), 在0.3 μm ~ 0.5 μm粒径的效率必须大于99.9996%(EN 1822-4:2009 Annex E.4 Leakcriteria Page 40)。可见由于粒径的不同,虽然得到的检测数据可能是相同的,但实际上效率却可能会相差一个甚至于几个数量级,这也是用户检漏数据会好于标准一个数量级的根本原因。上文分析了高效过滤器过滤层的风险问题,过滤层还有一个注意点:过滤风速(不同于过滤器的面风速)不应大于5 cm/s。
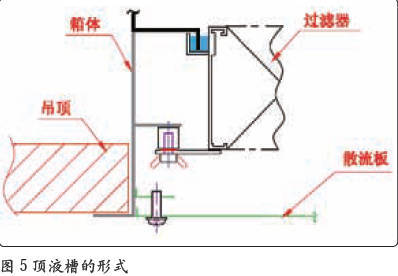
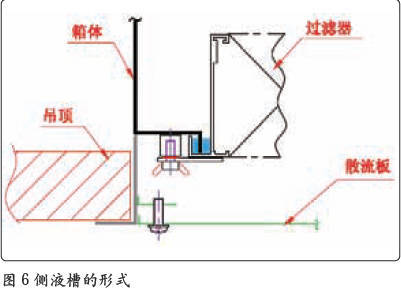
高效过滤器的安装框架如果不采用液槽密封的形式,边框结合部也是很难满足PAO 泄露率小于0.01% 的要求的。在高效过滤器与送风口的配合结构中,有两种形式:一种是顶液槽(如图5 所示)的形式,另一种是侧液槽(如图6 所示)的形式。这两种结构的形式都能够满足PAO 完整性检测的需要,但顶液槽的形式并不适合用于无菌制剂的生产。从图5中可以清晰地看到,高效过滤器与送风口之间有一个较大的死区域,过滤器的风是循环不到该区域的。
5.2 气流组织
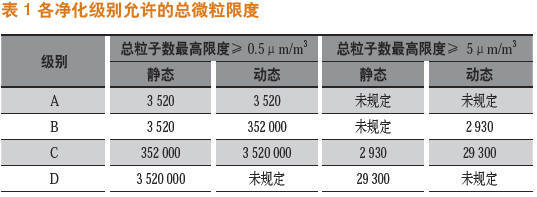
高效过滤器的完整性得到保障,仅仅解决了高效过滤出风的质量问题。不同的工艺操作还需要有相应的洁净等级来支持,GMP 对于不同的洁净等级都有着严格的界定标准和判定指标。各等级允许的总微粒限度,如表1所示。
A 级:进行高风险操作的关键区域,通常情况下,这种条件是通过局部气流保护实现的,应尽量减少操作人员对A 级区的直接干预。
B 级:对于无菌制备和灌装来说,这是A 级的背景洁净室。
C、D 级:在无菌灌装中执行不太关键步骤操作的区域,或作为隔离器的背景的洁净室。
房间的自净是通过连续换气来达到的。由高效过滤器吹出来的是无菌空气,它不断地置换和稀释房间内的空气,从而确保房间满足A、B、C、D 洁净等级的需要。不同洁净等级的房间需要不同的换气次数,但房间的气流组织流形比换气次数更重要。应尽量将房间设计成“顶送侧下回”的流形,否则房间会存在换气死角,当然若能够实现“顶送下回”是更为理想的。
不同级别的房间间会用压差来避免交叉污染,如若必要,相同级别的房间间也需要控制适当的压差。但在这方面有一个误区,就是认为压差越大越好。其实并非如此,一方面压差升高,建筑围护的风险就会增加;另一方面,也是更为重要的实际情况:压差是滞留在房间内的气体所生产的,压差越高滞留在房间内的气体就越多。这些滞留在房间内的气体停留时间是不一样的,不会像活塞流那样齐刷刷地进出,反而会影响房间的自净效果。因此,在做设计时,一旦发现核心区域的压力很高,就需要调整其压力的分布情况,合理采用不同气流形式的气闸间。
6. 质量回顾及趋势分析
虽然无菌生产不太适合采用回顾性验证,但在一些关键数据上还是可以用统计分析来进行质量回顾和趋势判断,从而评估污染和交叉污染的风险程度。本文接下来所讲的统计学分析,并不是简单地画USL( 上规格限)、LSL(下规格限)两条上下限,来查看运行数据是否落在之间。而是用工序能力指数来判断可靠性如何,将今年的可靠性与去年的可靠性进行比较。用USL、LSL只能够判断所取样品的数据情况,用工序能力指数则可以预见未取样数据的情况,下面将列举几个例子进行说明。
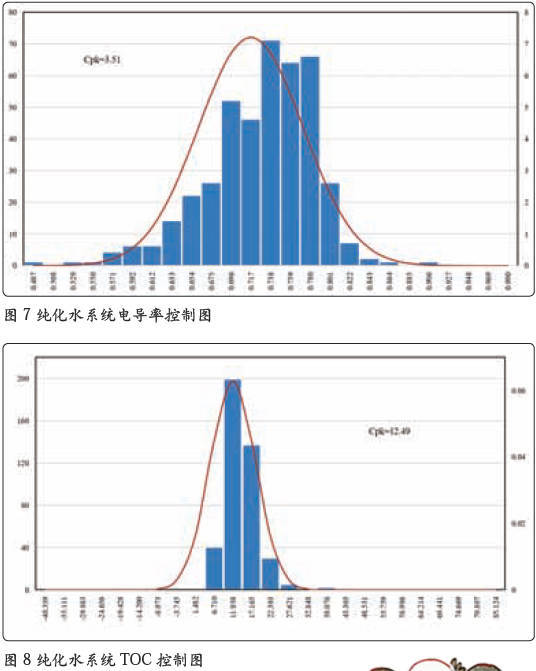
水系统方面已经基本实现了电导率、TOC(总有机碳)的在线监测,虽然微生物还是采用离线取样的方法进行监测,但对于这些监测得到的数据完全可以采用工序能力指数的统计方法进行判断和分析。图7-9 是根据纯化水系统一个完整年度的统计分析数据所做的控制图。
从图7、图8 和图9 的控制图上可以清晰地看出,工序能力指数最小的电导率控制图Cpk=3.51,也就是说出现电导率超过1.3 μS/cm的概率为十亿分之一。
同样道理, 灭菌柜在做Mapping 的时候,可以通过工序能力指数的方法来判断潜在未布点的不达标可能性有多大,干热和湿热灭菌柜都可以试用。
对于无菌冻干粉针剂的生产,也可以通过对成品中带黑点不合格品的数量进行统计,来对隧道烘箱高温高效过滤器进行研判,以便提前发现高效过滤器泄漏的趋势。
7. 结束语
本文从人、机、料、法、环方面简单地论述了污染可能存在的风险,但不同的设施结构和产品有着独特的情况,需要进行针对性的分析和评价。污染风险的识别和评估需要综合考虑,有时在一个方面将其做到极致的时候,在其他方面可能反而会出现问题。如上文提到的如果房间压差控制过大,会造成更多的气流被滞留在室内,远离了平推流的流形,反而会削弱自净的效率。
对于一些有量化数据指标的场景,可以采用工序能力指数来量化评判其风险的程度,这样做比一些定性评估更有说服力。一般认为静态的验证需要做三次,这是为了考察其重现性,如果用工序能力指数来评判就可以不必做满三次。
国家对于风险评估也有专门的技术规范:GB/T 27921-2011《风险管理风险评估技术》,可以根据GB/T 27921-2011 中推荐的方法来进行识别、评估和应对。在非最终灭菌无菌制剂的生产过程中,经常采用的风险评估技术为失效模式和后果分析。它能够很好地帮助企业化解识别的风险,直至最终达到可接受的水平为止。
文/ 王敦品 张耀良 崔吉想 欧阳健
制药工艺与装备
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多