2023Q1,FDA拒批6款药物
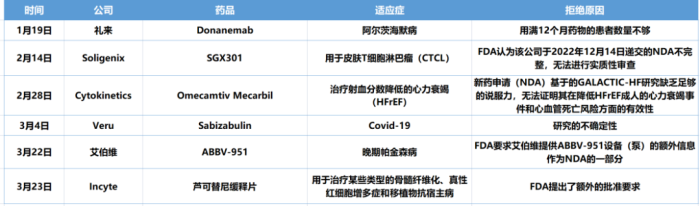
礼来
Soligenix
2月14日,Soligenix宣布收到FDA的RTF(Refuse to file)信函,意味着FDA否决了SGX301用于皮肤T细胞淋巴瘤(CTCL)的新药申请(NDA)。
FDA认为该公司递交的NDA不完整,无法进行实质性审查。受此消息影响,Soligenix公司股价暴跌约40%。
Cytokinetics
Veru
3月4日,FDA拒绝了Veru公司sabizabulin药物的紧急使用授权(EUA)申请,该药物用于治疗患有中度至重度Covid-19的住院成人患者,这些患者患有ARDS(急性呼吸窘迫综合征)的风险很高。
Veru首席执行官Mitchell Steiner表示,FDA拒绝使用该药是因为可能存在未知影响,或研究的不确定性。在咨询委员会之前准备的简报文件中,FDA对Veru提交的关键数据表达了担忧。FDA表示,在小型试验中,虽然sabizabulin达到了降低死亡率的目标,但指出了不确定性,即使这些不确定性在个体上没有问题,但对结果提出了疑问。
艾伯维
3月22日,艾伯维宣布,已收到FDA就ABBV-951(foslevodopa / foscarbidopa)新药上市申请发出的完整回复函。
在信中,FDA要求艾伯维提供ABBV-951设备(泵)的额外信息作为NDA的一部分,不需要再额外做与该药相关的疗效和安全性试验。艾伯维表示,将会尽快重新提交NDA。
Incyte
3月23日,Incyte宣布,FDA已就JAK1/JAK2抑制剂芦可替尼缓释片(每日1次)的上市申请发出了完整回复函(CRL)。该产品拟用于治疗某些类型的骨髓纤维化、真性红细胞增多症和移植物抗宿主病。
结语
美国一直是创新药的超级市场,被FDA批准上市往往相当于拿到了全球通行证。但近年来FDA在创新药的上市审批上日渐趋严,以高标准、高要求将多款创新药被拒之门外。上市申请被拒除了影响产品的商业化进程外,对于严重依赖于某一单品的小型制药公司更可能是致命的,很多公司在公布CRL消息后都遭遇了重大的股市打击。
内容来源:生物药大时代
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多